题目内容
20. 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X可能是( )①盐酸、Na2CO3溶液
②Cl2、Fe
③CO2、Ca(OH)2溶液
④NaOH溶液、AlCl3溶液
⑤偏铝酸钠溶液、盐酸
⑥氯化钙溶液、CO2
⑦钠、氧气.
| A. | ①②③④ | B. | ①③④⑤ | C. | ③④⑤⑦ | D. | ③④⑤⑥ |
分析 X和过量W,少量W反应生成本题物质YZ,Y和Z又可以相互转化,说明X若是单质,X乙酸化合价存在变价,只能是非金属单质;若X是化合物,则是酸性氧化物与碱反应,量不同产物不同,生成的正盐和酸式盐可以相互转化;或X为多元弱酸的盐与酸反应,量不同产物不同,结合选项分析判断.
①W为盐酸,X为Na2CO3溶液,则Y为碳酸钠,Z为碳酸氢钠,二者可以相互转化;
②W为Cl2、X为Fe,铁和氯气反应只能生成氯化铁;
③W为CO2、X为Ca(OH)2溶液,则Y为碳酸氢钙,Z为碳酸钙,二者可以相互转化;
④W为NaOH溶液、X为AlCl3溶液,则Z氢氧化铝,Y为偏铝酸钠,二者可以相互转化;
⑤W为偏铝酸钠溶液、X为盐酸,则Y为氯化铝,Z为氢氧化铝;
⑥氯化钙溶液和CO2不能发生反应;
⑦钠与氧气反应和量无关,和反应条件有关.
解答 解:①W为盐酸,X为Na2CO3溶液,则Y为碳酸钠,Z为碳酸氢钠,二者可以相互转化,碳酸钠和二氧化碳、水反应生成碳酸氢钠,碳酸氢钠分解生成碳酸钠,故①正确;
②W为Cl2、X为Fe,铁和氯气反应只能生成氯化铁,不能生成不同价态的化合物,故②错误;
③W为CO2、X为Ca(OH)2溶液,则Y为碳酸氢钙,Z为碳酸钙,二者可以相互转化,碳酸钙和二氧化碳、水反应生成碳酸氢钙,碳酸氢钙分解生成碳酸钙,故③正确;
④W为NaOH溶液、X为AlCl3溶液,Y为偏铝酸钠,则Z氢氧化铝,二者可以相互转化,偏铝酸钠和二氧化碳、水反应生成氢氧化铝,氢氧化铝和氢氧化钠反应生成偏铝酸钠,故④正确;
⑤W为偏铝酸钠溶液、X为盐酸,则Y为氯化铝,Z为氢氧化铝,氯化铝溶液中加入一水合氨生成氢氧化铝沉淀,氢氧化铝和盐酸反应生成氯化铝溶液,能实现转化,故⑤正确;
⑥氯化钙溶液和CO2不能发生反应,不能实现上述转化,故⑥错误;
⑦钠与氧气反应和量无关,和反应条件有关,钠和氧气点燃生成过氧化钠,常温反应生成氧化钠,和量无关,不能实现上述转化,故⑦错误;
故选B.
点评 本题考查元素化合物的推断,解题关键是根据已知信息结合化合物的性质分析、尝试确定各物质,各物质确定后抓住化学性质解决问题.本题涉及知识点较多,难度较大.

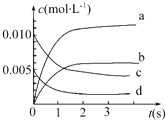 在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2变化曲线的是b.用O2表示0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)、铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为:PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断:
①工作时正极反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O.
②工作时,电解质溶液的pH值增大(“增大”、“减小”或“不变”)
③工作时,电解质溶液中阴离子移向负极.
(5)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652kJ的热量.
①反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ•mol-1.
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
③发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气.已知:
N2(g)+2O2(g)═2NO2(g),△H=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1
肼和二氧化氮反应的热化学方程式为N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85 kJ•mol-1.
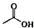 +
+ $\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$
$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$ +H2O
+H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的名称是:球形冷凝管;
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸; 第二次水洗的主要目的是:洗掉碳酸氢钠;
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高醇的转化率;
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯;
(6)在图2蒸馏操作中,仪器选择及安装都正确的是:b(填标号);
(7)本实验的产率是:c;A.30% B.40% C.50% D.60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量未反应的异戊醇.

| A. | 日常生活中无水乙醇常用于杀菌消毒 | |
| B. | 用乙醇作萃取剂可以将碘从碘水中萃取出来 | |
| C. | 乙醇、乙烷和苯都可以与钠反应生成氢气 | |
| D. | 乙醇是一种可再生能源 |
| A. |  生成炭黑的实验 | B. |  净水 | ||
| C. |  自制汽水 | D. |  将鸡蛋壳放入醋中 |
| A. | 分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球插入蒸馏烧瓶中液体的液面以下 | |
| C. | 可用酒精萃取碘水中的碘 | |
| D. | 称量时,称量物放在托盘天平的右盘,砝码放在托盘天平的左盘 |
| A. | 2molCl2 | B. | 3.01×1023个氧分子 | ||
| C. | 2g氢气 | D. | 标准状况下,11.2LHe |
| A. | 3:4:1 | B. | 3:3:2 | C. | 6:7:3 | D. | 6:9:0.5 |