题目内容
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| | | | |||||||||||||||
| | | | | | a | | b | | |||||||||
| | | c | | | d | e | | ||||||||||
| | | | | | | | | f | | g | | | | | | | |
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: 。
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) 。
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f 3+ 的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
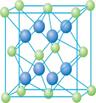
(5)c单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
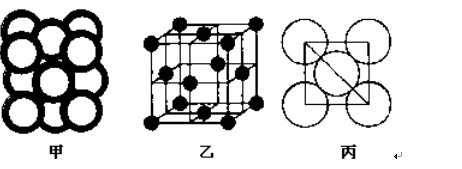
c单质晶体中原子的配位数为 。若已知c的原子半径为r,NA代表阿伏加德罗常数,c的相对原子质量为M。该晶体的密度为 (用字母表示)。
1) 三角锥 sp3 平面三角形 sp2 非极性分子
(2)HF ,HF中有氢键
(3)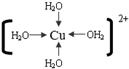 (4)[Co(NH3)5SO4]Br, NH3、SO42-
(4)[Co(NH3)5SO4]Br, NH3、SO42-
(5) 12、 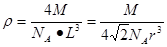
解析试题分析:根据元素在周期表中的位置可确定a是N;b是F;c是Al;d是S;e是Cl;f是Co;g是Cu。(1)NH3分子构型为三角锥型;中心原子N的杂化形式为sp3杂化;SO3分子构型为平面三角形;中心原子S的杂化形式为sp2;由于各个化学键的排列是对称的,所以该分子是非极性分子。(2)在HF、H2S、HCl三种物质中由于在HF的分子之间存在氢键,增加了分子之间的相互作用力,所以HF的沸点最高。(3)在溶液中Cu2+是以四水和铜离子的形式存在的,其结构简式是 。(4)Co(NH3)5BrSO4。Co3+ 的配位数是6可形成两种配合物为确定f的配合物的结构,在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,证明SO42-不是配位体;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,证明在化合物中SO42-是配位体。则第二种配合物的化学式[Co(NH3)5SO4]Br;该配合物的配体是NH3及SO42-。(5)Al单质晶体中原子的堆积方式为立方面心堆积。则Al单质晶体中原子的配位数为(3×8)÷2=12;在每个晶胞中含有的Al原子的个数为8×1/8+6×1/2=4.由于的原子半径为r,所以晶胞的边长
。(4)Co(NH3)5BrSO4。Co3+ 的配位数是6可形成两种配合物为确定f的配合物的结构,在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,证明SO42-不是配位体;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,证明在化合物中SO42-是配位体。则第二种配合物的化学式[Co(NH3)5SO4]Br;该配合物的配体是NH3及SO42-。(5)Al单质晶体中原子的堆积方式为立方面心堆积。则Al单质晶体中原子的配位数为(3×8)÷2=12;在每个晶胞中含有的Al原子的个数为8×1/8+6×1/2=4.由于的原子半径为r,所以晶胞的边长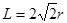 。则该晶体的密度为
。则该晶体的密度为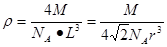 。
。
考点:考查元素的推断、物质的分子结构、晶体结构及晶体密度的计算的知识。

(12分)【化学一物质结构与性质】
根据物质结构与性质的关系,请回答下列问题:
(1)基态铬(Cr)原子的价电子排布式是________,这样排布使整个体系能量最低,原因是________。
(2)氨水中存在多种形式的氢键,其中与“氨极易溶于水”这种性质相关的氢键可表示为:_________。解释NH3分子中键角大于H2O中的键角的原因是_________ 。
(3)下列各项的比较中正确的是_________。
| A.第一电离能:Mg>Al | B.电负性:P>Ge |
| C.稳定性:AsH3>H2S | D.金属性: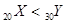 |
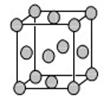
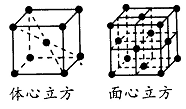
结构如图所示,体心立方晶胞和面心立方晶胞中实际含有的
Fe原子个数之比为_________。
【物质结构与性质】
过渡元素具有较多的空轨道,所以第四周期的Cr、Fe、Co、Ni、Cu、Zn等多种金属能形成配合物。
(1)基态Cu原子的核外电子排布式为 ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下: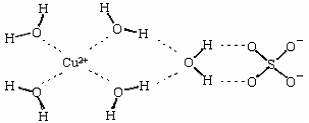
图中虚线表示的作用力为 ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是 ,其中心原子的杂化轨道类型是 ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4易溶于下列 。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
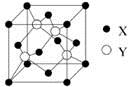
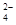 的空间构型是 ,其中D原子的杂化轨道类型是 。
的空间构型是 ,其中D原子的杂化轨道类型是 。