题目内容
(12分)【化学-物质结构与性质】
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
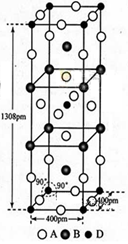
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。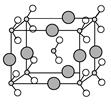
(共12分)
(1)[Ar]3d104s1(2分)
(2)N>O>C(2分)
(3)B的氢化物分子之间存在氢键(2分)
(4)[N=C=O]-(2分)
(5)sp(2分)
(6)NaNO2(2分)
解析试题分析:原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等,原子核外电子排布式为1s22s22p2,故A为碳元素;C的基态原子2p能级上的未成对电子数与A原子的相同,则C原子核外电子排布式为1s22s22p4,故C为O元素,由原子序数可知B为N元素;F的原子序数为29,则F为Cu;E和C位于同一主族,则E为S元素;D为它所在周期中原子半径最大的主族元素,处于ⅠA族,原子序数大于O元素小于S元素,故D为Na。
(1)F原子核外电子数为29,基态的核外电子排布式为[Ar]3d104s1。
(2)同周期随原子序数增大元素第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处 于半满稳定状态,能量较低,第一电离能高于氧元素,故第一电离能N>O>C。
(3)NH3分子之间存在氢键,CH4分子间的作用是范德华力,氢键比范德华力更强,故其沸点高于CH4。
(4)OCN-与CO2互为等电子体,价电子总数相等,二者结构类似,则OCN-的结构式为[N=C=O]-
(5)元素C与S所形成的常见化合物为CS2,CS2的结构类似于CO2,S原子的杂化方式与CO2中C原子的杂化方式相同,为sp杂化。
(6)由晶胞结构可知,晶胞中存在NO2-结构微粒,位于顶点和体心,微粒数目=1+8×1/8=2,
Na+位于8条棱的中心,数目=8×1/4=2,故该化合物的化学式为NaNO2。
考点:本题考查核外电子排布、元素周期律、分子结构、等电子体、杂化轨道、晶胞计算。

下表中所列的字母分别代表某一化学元素。完成下列填空:
| a | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | b | | |
| c | | | | | | | | | | | | d | | | e | f | |
| | | | | | | | | | | | | | g | | | | |
| | | | | | | | | | | | | | | | h | | |
| | i | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(1)h的最外层有____种运动状态的电子。a、b、c三种元素形成的化合物电子式为________。
(2)d单质溶于i的最高价氧化物对应水化物的溶液时发生反应的离子方程式为____________。
(3) 元素e与f元素相比,非金属性较强的是__________(写元素符号),下列表述中能证明这一事实的是__________(选填序号)。
a. e的阴离子还原性强于f的阴离子 b. f的氢化物酸性强于e的氢化物
c. e单质的熔点高于f单质 d. e和f形成的化合物中,e显正价,f显负价
(4)元素X(非a~i元素)是所在周期原子半径最大的非金属元素,它的气态氢化物为三角锥形极性分子,写出X在周期表中的位置_______________________________。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| | | | |||||||||||||||
| | | | | | a | | b | | |||||||||
| | | c | | | d | e | | ||||||||||
| | | | | | | | | f | | g | | | | | | | |
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: 。
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) 。
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f 3+ 的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
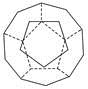
(5)c单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
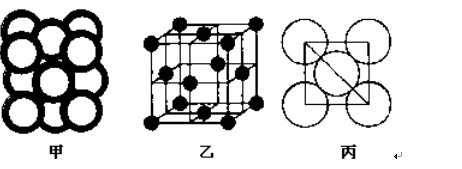
c单质晶体中原子的配位数为 。若已知c的原子半径为r,NA代表阿伏加德罗常数,c的相对原子质量为M。该晶体的密度为 (用字母表示)。
下列分子或离子中,含有孤对电子的是
A.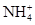 | B.CH4 | C.H2S | D.SiH4 |

 ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子 Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。