题目内容
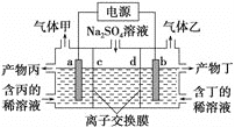
【题目】如图X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。

(1)①电源上b为___极
②Z槽中e为___极。
③连接Y、Z槽线路中,电子流动的方向是d___e(用“→”或“←”填空)。
(2)①写出Y槽中总反应的化学方程式:____。
②写出Z槽中e极上反应的电极反应式:___。
【答案】负 阳 ← 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ Cu-2e-===Cu2+
2NaOH+H2↑+Cl2↑ Cu-2e-===Cu2+
【解析】
根据装置图,Y、Z为电解池,Y槽中c、d为石墨棒,d附近显红色,发生2H2O+2e-=H2↑+2OH-,作阴极,则f为阴极,b为电池的负极。
(1)①分析可知,电源上b为负极;
②电池a极为正极,则Z槽中e为阳极;
③导线中电子由负极流向正极,则电子流动的方向是d←e;
(2)①Y槽阴极反应式为2Cl--2e-=Cl2↑,则总反应式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
②Z槽中e极为阳极,铜失电子生成铜离子,电极式为Cu-2e-===Cu2+。

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目