题目内容
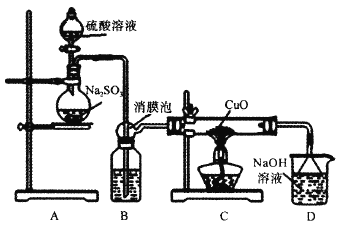
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。已知Cu2O+2H+=Cu+Cu2++H2O。回答下列相关问题:
Ⅰ.SO2还原CuO的探究
(1)装置B中宜放入的试剂为___,消膜泡的作用是__。
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是__。
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为__。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、___、玻璃棒和试剂瓶。
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为____(写表达式)。
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值____(填“偏大”或“偏小”)。为减少实验误差,滴定过程中,常常在接近终点时加入KSCN,使CuI转化为溶解度更小的CuSCN,该沉淀物对I3-吸附能力极弱,KSCN加入太早,I2的浓度较大,I2会将SCN-氧化生成SO42-和ICN,该反应的离子方程式为___。
【答案】浓硫酸 防止B中液体被吹入装置C中 98%的H2SO4溶液中c(H+)较小,反应速率较小 3CuO+SO2![]() CuSO4+Cu2O 量筒
CuSO4+Cu2O 量筒 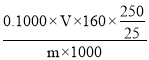 ×100% 偏小 SCN-+4I2+4H2O=SO42-+7I-+ICN+8H+
×100% 偏小 SCN-+4I2+4H2O=SO42-+7I-+ICN+8H+
【解析】
实验室一般用中等浓度的硫酸和亚硫酸盐反应制备SO2,所以装置A是制备SO2的装置,发生的反应为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,制备的SO2中含有水蒸气,应用浓硫酸干燥,消膜泡防止B中的浓硫酸被SO2的气流吹入C装置中,SO2进入C装置中与CuO发生氧化还原反应,其反应方程式为:3CuO+SO2![]() CuSO4+Cu2O,多余的SO2被NaOH溶液吸收,D装置是尾气处理装置。
CuSO4+Cu2O,多余的SO2被NaOH溶液吸收,D装置是尾气处理装置。
Ⅰ.(1)制备SO2时含有水蒸气杂质,应用浓硫酸干燥,所以装置B中放入浓硫酸,目的是除去水蒸气;消膜泡所起的主要作用是防止B中的浓硫酸被SO2的气流吹入C装置中,故答案为:浓硫酸;防止B中液体被吹入装置C中;
(2)制取SO2的反应实质是氢离子和亚硫酸根离子反应,98%的硫酸溶液中溶质主要是硫酸分子,而氢离子浓度较小,所以反应速率较慢,故答案为:98%的H2SO4溶液中c(H+)较小,反应速率较小;
(3)根据信息,可以得出产物有硫酸铜和氧化亚铜,其反应方程式为:3CuO+SO2![]() CuSO4+Cu2O,故答案为:3CuO+SO2
CuSO4+Cu2O,故答案为:3CuO+SO2![]() CuSO4+Cu2O;
CuSO4+Cu2O;
Ⅱ. (4)①标准溶液滴定前需要标定,不需要特别精准体积的容量瓶,所以配制Na2S2O3标准溶液时需要的玻璃仪器除了烧杯、玻璃棒和试剂瓶外,配制时选取量筒即可,故答案为:量筒;
②根据相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-,可以得出关系式:Cu2+
I3-,I2+2S2O32-=S4O62-+2I-,可以得出关系式:Cu2+![]() S2O32-,n(Cu2+)= n(S2O32-)=(0.1000×V×10-3)mol,则mg生成物中硫酸铜质量分数为:
S2O32-,n(Cu2+)= n(S2O32-)=(0.1000×V×10-3)mol,则mg生成物中硫酸铜质量分数为: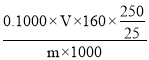 ×100%,故答案为:
×100%,故答案为: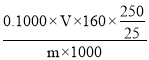 ×100%;
×100%;
③因为CuI沉淀对I3-具有强的吸附能力,会造成碘单质实际消耗量偏少,由此造成硫酸铜质量分数测定值偏小;根据氧化还原反应特点,可以得出碘单质与硫氰化钾之间的离子反应方程式为:SCN-+4I2+4H2O=SO42-+7I-+ICN+8H+,故答案为:SCN-+4I2+4H2O=SO42-+7I-+ICN+8H+。