题目内容
9.两种气态烃的混合物共2.24L(标准状况),完全燃烧后得3.36L(标准状况)二氧化碳和2.7g的水.下列说法中正确的是( )| A. | 混合气体中一定含有乙烯 | |
| B. | 混合气体中一定含有甲烷 | |
| C. | 混合气体中一定含有乙炔 | |
| D. | 混合气体一定是由烷烃和烯烃构成的混合物 |
分析 根据n=$\frac{V}{{V}_{m}}$计算出标况下2.24L混合气体、3.36L二氧化碳的物质的量,再根据n=$\frac{m}{M}$计算出水的物质的量,从而可确定混合物的平均分子式,根据计算结果对各选项进行判断.
解答 解:标况下2.24L混合气体的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
标况下3.36L二氧化碳的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,0.15mol二氧化碳中含有0.15molC,
2.7g水的物质的量为$\frac{2.7g}{18g/mol}$=0.15mol,0.15mol水中含有0.3molH,
则该混合烃中含有的平均C、H原子数为:N(C)=$\frac{0.15mol}{0.1mol}$=1.5、N(H)=$\frac{0.3mol}{0.1mol}$=3,
该混合烃的平均分子式为C1.5H3,
碳原子数小于1.5的烃只有甲烷,则一定含有CH4,
甲烷分子中H原子数为4>3,则另一种烃分子中H原子数<3,且C原子数>1.5,满足该条件的烃只有乙炔,
故该气体为甲烷和乙炔的混合烃,
故选BC.
点评 本题考查了混合物反应的计算,题目难度中等,注意掌握质量守恒定律、平均值法在化学计算中的应用,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
19.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质( )
| A. | 锌粉 | B. | 镁粉 | C. | 铁粉 | D. | 铝粉 |
20.用NA一表示阿伏加德罗常数的值.下列判断错误的是( )
| A. | NA个H+的质量为1g | |
| B. | 32g O2中含有2NA个O原子 | |
| C. | 2 L 0.5mol/LNa2SO4溶液中含NA个Na+ | |
| D. | 标准状况下,1 molH2O中含有10NA个质子 |
17.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| D. | 标准状况下,22.4 L氧气作氧化剂时转移电子数为4NA |
4.如图是氩元素在元素周期表中的具体信息.其中39.95是( )


| A. | 氩的原子序数 | B. | 氩原子的质量数 | ||
| C. | 氩元素的相对原子质量 | D. | 氩原子的相对原子质量 |
14.下列反应的离子方程式书写错误的是( )
| A. | Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液:Ca2++2HCO3-+Ba2++2OH-=CaCO3↓+BaCO3↓+2H2O | |
| B. | 3molCl2通入含2molFeI2的溶液中:2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2 | |
| C. | 往Ba(OH)2溶液中逐滴加入NH4Al(SO4)2溶液,可能发生反应的离子方程式是Al3++SO42-+Ba2++3OH-=BaSO4↓+Al(OH)3↓ | |
| D. | 向苯酚钠溶液中通入少量的CO2: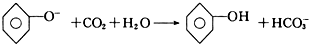 |
1.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A. | 左、下方区域的金属元素 | |
| B. | 右、上方区域的非金属元素 | |
| C. | 金属元素与非金属元素分界线附近的元素 | |
| D. | 过渡元素中 |
18.某有机物A是农药生产中的一种中间体,其结构简式如图.则下列叙述正确的是( )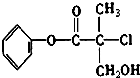

| A. | 有机物A分子式为C10H12O3Cl | |
| B. | 有机物A可以和Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| D. | 1molA和足量的NaOH溶液反应,最多可以消耗3mol NaOH |
19.下列物质的电子式书写正确的是( )
| A. | NaCl Na+${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$ | B. | H2S H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-H+ | ||
| C. | N2  | D. | NH4I  |