题目内容
19.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质( )| A. | 锌粉 | B. | 镁粉 | C. | 铁粉 | D. | 铝粉 |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不能改变,或是改变后易复原.除杂质至少要满足两个条件:①加入的试剂只能与杂质反应、不能与原物质反应或是能与原物质反应,但反应后原物质易复原②反应后不能引入新的杂质或引入的杂质易除去.
解答 解:要除去FeSO4溶液中的CuSO4和Fe2(SO4)3,实质就是除去Cu2+和Fe3+,但不能将Fe2+反应掉、引入新杂质.
A、加入锌粉,由于Zn在Cu和Fe之前,能锌粉将Cu2+、Fe3+和Fe2+均置换为Cu和Fe,故A错误;
B、加入镁粉,由于Mg在Cu和Fe之前,故镁粉能将Cu2+、Fe3+和Fe2+均置换为Cu和Fe,故B错误;
C、加入铁粉,发生:CuSO4+Fe=FeSO4+Cu,Fe2(SO4)3+Fe=3FeSO4,然后过滤即可,能除去杂质且没有引入新的杂质,符合除杂原则,故C正确;
D、加入铝粉,由于Al在Cu和Fe之前,故铝粉能将Cu2+、Fe3+和Fe2+均置换为Cu和Fe,故D错误;
故选C.
点评 本题考查了物质的分离与除杂,解决除杂问题时,应注意避免原物质被反应掉和杂质离子的引入是正确解题的关键.

练习册系列答案
相关题目
9.室温下,0.1mol/L的二元酸H2A溶液中,溶液体系可能存在的含A粒子(H2A、HA-、A2-)所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
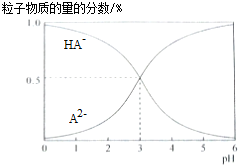

| A. | H2A的电离方程式为:H2A?H++HA- | |
| B. | pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100 | |
| C. | 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-) | |
| D. | Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0 |
10.下列化学式只能表示一种物质的是( )
| A. | C3H8 | B. | C4H10 | C. | C4H8 | D. | C2H6O |
7.将过量铁粉放入硝酸锌和硝酸银的混合溶液中,充分反应后过滤,滤液中的金属离子是( )
| A. | Fe2+ | B. | Fe2+、Zn2+ | C. | Fe2+、Ag+ | D. | Fe2+、Fe3+ |
4.下列说法中正确的是( )
| A. | 完全由非金属组成的化合物不一定是共价化合物 | |
| B. | 构成分子晶体的粒子一定含有共价键 | |
| C. | 分子晶体的熔点一定比金属晶体的熔点低 | |
| D. | 含有金属离子的晶体一定是离子晶体 |
11.下列工业生产的主要反应中,涉及置换反应的是( )
| A. | 制取粗硅 | B. | 海水提镁 | C. | 电解制铝 | D. | 制备硫酸 |
8.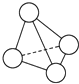 N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
 N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )| A. | 1 mol N4气体转变为N2将放出775 kJ热量 | |
| B. | 1 mol N4气体转变为N2将放出882 kJ热量 | |
| C. | 1 mol N4气体转变为N2将吸收775 kJ热量 | |
| D. | 1 mol N4气体转变为N2将吸收882 kJ热量 |
9.两种气态烃的混合物共2.24L(标准状况),完全燃烧后得3.36L(标准状况)二氧化碳和2.7g的水.下列说法中正确的是( )
| A. | 混合气体中一定含有乙烯 | |
| B. | 混合气体中一定含有甲烷 | |
| C. | 混合气体中一定含有乙炔 | |
| D. | 混合气体一定是由烷烃和烯烃构成的混合物 |