题目内容
18.某有机物A是农药生产中的一种中间体,其结构简式如图.则下列叙述正确的是( )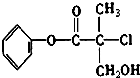
| A. | 有机物A分子式为C10H12O3Cl | |
| B. | 有机物A可以和Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| D. | 1molA和足量的NaOH溶液反应,最多可以消耗3mol NaOH |
分析 有机物由C、H、O、Cl等元素组成,属于烃的衍生物,分子中含有-COO-、-Cl、-OH等官能团,可发生水解等反应,含有苯环,还可发生加成反应,以此解答该题.
解答 解:A.由结构简式可知有机物分子式为C10H10O3Cl,故A错误;
B.分子中不含C=C,则不能和Br的CCl4溶液发生加成反应,故B错误;
C.与-OH相连的碳的邻位碳原子上无氢原子,在浓H2SO4作用下,不可发生消去反应,故C错误;
D.A与足量NaOH溶液反应为: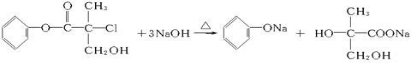 +NaCl+H2O,则1molA和足量的NaOH溶液反应,最多可以消耗3molNaOH,故D正确.
+NaCl+H2O,则1molA和足量的NaOH溶液反应,最多可以消耗3molNaOH,故D正确.
故选D.
点评 本题考查有机物的结构和性质,题目难度中等,本题注意把握有机物的结构和官能团的性质,易错点为D,注意发生消去反应的特点.

练习册系列答案
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
8.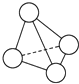 N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
 N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )| A. | 1 mol N4气体转变为N2将放出775 kJ热量 | |
| B. | 1 mol N4气体转变为N2将放出882 kJ热量 | |
| C. | 1 mol N4气体转变为N2将吸收775 kJ热量 | |
| D. | 1 mol N4气体转变为N2将吸收882 kJ热量 |
9.两种气态烃的混合物共2.24L(标准状况),完全燃烧后得3.36L(标准状况)二氧化碳和2.7g的水.下列说法中正确的是( )
| A. | 混合气体中一定含有乙烯 | |
| B. | 混合气体中一定含有甲烷 | |
| C. | 混合气体中一定含有乙炔 | |
| D. | 混合气体一定是由烷烃和烯烃构成的混合物 |
6.1,2,3-三苯基环丙烷的三个苯基可以分布在环丙烷环平面的上下,因此有如下两个异构体: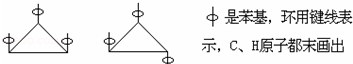
据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数目是( )

据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数目是( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
13.下列结论中你认为肯定正确的是( )
①微粒半径:S2->Cl->Na+>Al3+ ②氢化物的稳定性:HF>HCl>H2S>H2Se
③氧化性:Cl2>S>Se>Te ④酸性:H2SO4>HClO4>H2SeO4
⑤得电子能力:F>Cl>Br>I ⑥还原性:F->Cl->Br-.
①微粒半径:S2->Cl->Na+>Al3+ ②氢化物的稳定性:HF>HCl>H2S>H2Se
③氧化性:Cl2>S>Se>Te ④酸性:H2SO4>HClO4>H2SeO4
⑤得电子能力:F>Cl>Br>I ⑥还原性:F->Cl->Br-.
| A. | 只有① | B. | ①②④⑥ | C. | ①②③⑤ | D. | 只有⑤ |
7.化学反应一般均会伴随着能量变化,对H2在O2中燃烧的反应,正确的是( )
| A. | 该反应为放热反应 | B. | 该反应为吸热反应 | ||
| C. | 断裂H-H键吸收能量 | D. | 生成H-O键放出能量 |
9.以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3•6H2O)的工艺流程如图:
回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是增大反应物的接触面积,提高原料的利用率.该反应的化学方程式4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应中被氧化的元素是S和Fe.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解;
(3)操作a为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,获得FeCl3•6H2O;
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:
根据表中的数据判断该反应的正向属于放热(填“放热“或”吸热“)反应,理由是压强一定时,温度升高,SO2转化率下降,说明升温平衡逆向移动,则正向放热.
(5)计算每生产1万吨98%硫酸所需要含80%FeS2的硫铁矿为7894.7吨(假设反应过程中硫的损失率为5%,结果保留一位小数).

回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是增大反应物的接触面积,提高原料的利用率.该反应的化学方程式4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应中被氧化的元素是S和Fe.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解;
(3)操作a为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,获得FeCl3•6H2O;
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:
| 0.1 | 0.5 | 1 | 10 | |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
(5)计算每生产1万吨98%硫酸所需要含80%FeS2的硫铁矿为7894.7吨(假设反应过程中硫的损失率为5%,结果保留一位小数).
 实验室制取乙烯的装置如图所示,请回答:
实验室制取乙烯的装置如图所示,请回答: