题目内容
19.下列物质的电子式书写正确的是( )| A. | NaCl Na+${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$ | B. | H2S H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-H+ | ||
| C. | N2  | D. | NH4I  |
分析 A.氯化钠为离子化合物,氯离子核外电子没有标出;
B.硫化氢是H和S构成的共价化合物;
C.氮气分子中存在氮氮三键,氮原子最外层为8电子;
D.碘化铵是离子化合物,由氨根离子与碘离子构成.
解答 解:A.氯化钠为离子化合物,氯离子带电荷并需用方括号括起来,钠离子用离子符号表示,电子式: ,故A错误;
,故A错误;
B.硫化氢是共价化合物,不存在离子键,硫原子与氢原子间形成1对共用电子对,电子式为 ,故B错误;
,故B错误;
C.氮气分子中存在氮氮三键,氮原子最外层为8电子,N2的电子式为: ,故C正确;
,故C正确;
D.碘化铵是离子化合物,由氨根离子与碘离子构成,电子式为: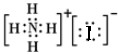 ,故D错误,
,故D错误,
故选C.
点评 本题考查电子式的判断,难度不大,要明确用电子式表示离子化合物、共价化合物、阴离子及单质分子的方法.

练习册系列答案
相关题目
9.两种气态烃的混合物共2.24L(标准状况),完全燃烧后得3.36L(标准状况)二氧化碳和2.7g的水.下列说法中正确的是( )
| A. | 混合气体中一定含有乙烯 | |
| B. | 混合气体中一定含有甲烷 | |
| C. | 混合气体中一定含有乙炔 | |
| D. | 混合气体一定是由烷烃和烯烃构成的混合物 |
7.化学反应一般均会伴随着能量变化,对H2在O2中燃烧的反应,正确的是( )
| A. | 该反应为放热反应 | B. | 该反应为吸热反应 | ||
| C. | 断裂H-H键吸收能量 | D. | 生成H-O键放出能量 |
14.下列物质不是白色固体的是( )
| A. | 碳酸钠 | B. | 氢氧化镁 | C. | 过氧化钠 | D. | 氧化铝 |
4.设NA为阿伏加德罗常数的数值,则下列说法中正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 1 mol CH4所含质子数目为10NA | |
| C. | 标准状况下22.4 L H2O所含分子数目为NA | |
| D. | 18g NH4+所含电子数目为10NA |
9.以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3•6H2O)的工艺流程如图:
回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是增大反应物的接触面积,提高原料的利用率.该反应的化学方程式4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应中被氧化的元素是S和Fe.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解;
(3)操作a为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,获得FeCl3•6H2O;
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:
根据表中的数据判断该反应的正向属于放热(填“放热“或”吸热“)反应,理由是压强一定时,温度升高,SO2转化率下降,说明升温平衡逆向移动,则正向放热.
(5)计算每生产1万吨98%硫酸所需要含80%FeS2的硫铁矿为7894.7吨(假设反应过程中硫的损失率为5%,结果保留一位小数).

回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是增大反应物的接触面积,提高原料的利用率.该反应的化学方程式4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应中被氧化的元素是S和Fe.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解;
(3)操作a为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,获得FeCl3•6H2O;
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:
| 0.1 | 0.5 | 1 | 10 | |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
(5)计算每生产1万吨98%硫酸所需要含80%FeS2的硫铁矿为7894.7吨(假设反应过程中硫的损失率为5%,结果保留一位小数).
10.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | 0.1mol/LNa2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(C032-) | |
| B. | 向0.1mol/L氯化铵溶液中滴加浓盐酸可能有c(NH4+)=c(H+) | |
| C. | pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH>7 | |
| D. | 将0.2mol/LNaA溶液和某浓度的盐酸等体积混合所得中性溶液中:c(Na+)=c(A-)+c(Cl-)=0.2mol/L |
 实验室制取乙烯的装置如图所示,请回答:
实验室制取乙烯的装置如图所示,请回答:
 ,该反应的类型为酯化反应;
,该反应的类型为酯化反应; ;
;