题目内容
17.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| D. | 标准状况下,22.4 L氧气作氧化剂时转移电子数为4NA |
分析 A、过氧化钠中的阴离子为过氧根离子,硫化钠和过氧化钠的摩尔质量都是78g/mol;
B、12.5mL 16mol/L浓硫酸溶质物质的量=0.0125L×16mol/L=0.2mol,全部反应生成二氧化硫0.1mol,随反应进行浓度减小,稀硫酸不和铜反应;
C、铁和氯气反应生成氯化铁,依据全部反应的物质计算电子转移;
D、氧气与金属钠加热反应生成过氧化钠,1mol氧气完全反应转移2mol电子.
解答 解:A、7.8g Na2S和Na2O2的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,过氧化钠中阳离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数等于0.1NA,故A正确;
B、12.5mL 16mol/L浓硫酸溶质物质的量=0.0125L×16mol/L=0.2mol,全部反应生成二氧化硫0.1mol,随反应进行浓度减小,稀硫酸不和铜反应,转移的电子数小于0.1NA,故B错误;
C、5.6g铁粉物质的量为0.1mol,在0.1mol氯气中充分燃烧,氯气全部反应转移电子数为0.2NA,故C错误;
D、标准状况下,22.4 L氧气的物质的量为1mol,钠与氧气燃烧的反应中,1mol氧气完全反应生成1mol过氧化钠,转移了2mol电子,转移电子数一定为2NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
7.将过量铁粉放入硝酸锌和硝酸银的混合溶液中,充分反应后过滤,滤液中的金属离子是( )
| A. | Fe2+ | B. | Fe2+、Zn2+ | C. | Fe2+、Ag+ | D. | Fe2+、Fe3+ |
8.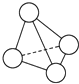 N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
 N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )| A. | 1 mol N4气体转变为N2将放出775 kJ热量 | |
| B. | 1 mol N4气体转变为N2将放出882 kJ热量 | |
| C. | 1 mol N4气体转变为N2将吸收775 kJ热量 | |
| D. | 1 mol N4气体转变为N2将吸收882 kJ热量 |
5.下列实验操作或叙述正确的是( )
| A. | 通过导电实验证明氢氧化铁胶体带正电 | |
| B. | 除去苯中溶有的少量乙醇,加入水,振荡,然后分液 | |
| C. | 进行蒸馏操作时.应用温度计准确测量沸腾液体的温度 | |
| D. | 从海带中提取碘时用到的药品有双氧水和NaOH溶液 |
9.两种气态烃的混合物共2.24L(标准状况),完全燃烧后得3.36L(标准状况)二氧化碳和2.7g的水.下列说法中正确的是( )
| A. | 混合气体中一定含有乙烯 | |
| B. | 混合气体中一定含有甲烷 | |
| C. | 混合气体中一定含有乙炔 | |
| D. | 混合气体一定是由烷烃和烯烃构成的混合物 |
6.1,2,3-三苯基环丙烷的三个苯基可以分布在环丙烷环平面的上下,因此有如下两个异构体: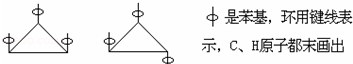
据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数目是( )

据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数目是( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
7.化学反应一般均会伴随着能量变化,对H2在O2中燃烧的反应,正确的是( )
| A. | 该反应为放热反应 | B. | 该反应为吸热反应 | ||
| C. | 断裂H-H键吸收能量 | D. | 生成H-O键放出能量 |
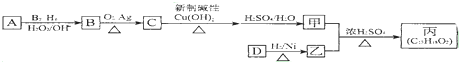
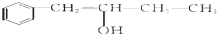
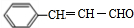
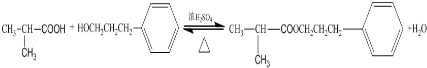 ,该反应类型为酯化反应:
,该反应类型为酯化反应: