��Ŀ����
����Ŀ��CH4��N2һ����������ֱ�����ɰ���3CH4��g��+2N2��g��![]() 3C��s��+4NH3��g����Q��700��ʱ��CH4��N2�ڲ�ͬ���ʵ���֮��[n��CH4��/n��N2��]ʱCH4��ƽ��ת��������ʾ����ȷ����
3C��s��+4NH3��g����Q��700��ʱ��CH4��N2�ڲ�ͬ���ʵ���֮��[n��CH4��/n��N2��]ʱCH4��ƽ��ת��������ʾ����ȷ����
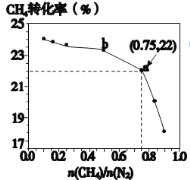
A.n��CH4��/n��N2��Խ��CH4��ת����Խ��
B.n��CH4��/n��N2������ʱ�����£�NH3���������������
C.b���Ӧ��ƽ�ⳣ����a��Ĵ�
D.a���Ӧ��NH3���������ԼΪ13%
���𰸡�BD
��������
��ͼ��֪��������Ϊ�����ת���ʣ�������Ϊ![]() ��
��![]() Խ�����ת����ԽС��ƽ�������ƶ�ʱ�������������������ƽ�ⳣ��ֻ���¶��йأ�������a�����ת����Ϊ
Խ�����ת����ԽС��ƽ�������ƶ�ʱ�������������������ƽ�ⳣ��ֻ���¶��йأ�������a�����ת����Ϊ![]() ���㰱��������������Դ������
���㰱��������������Դ������
A����ͼ����![]() ��ת������
��ת������![]() ����������ͣ�A����
����������ͣ�A����
B��![]() ���÷�Ӧ�����ȷ�Ӧ�������¶�ƽ�������ƶ���
���÷�Ӧ�����ȷ�Ӧ�������¶�ƽ�������ƶ���![]() ���������������B��ȷ��
���������������B��ȷ��
C��ab������¶���ͬ��ƽ�ⳣ��ֻ���¶��йأ���ƽ�ⳣ�����䣬C����
D��a�����ת����Ϊ![]() ��
��![]() ���������Ϊ3mol������Ϊ4mol��
���������Ϊ3mol������Ϊ4mol�� ![]()
![]()
![]()
��ʼ 3 4 0
ת��![]()
![]()
![]()
ƽ�� ![]()
![]()
![]()
��![]() ���������ԼΪ
���������ԼΪ![]() ��D��ȷ��
��D��ȷ��
��ѡBD��

����Ŀ������������������Ⱦ����ҪϤ���о���
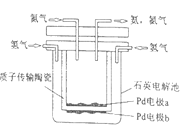
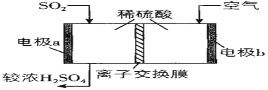
(1)������������ڴ����������ᡣ���Ṥҵ�У���Ϊ������ V2O5�Է�Ӧ I �Ĵ�ѭ�����̾����ˢ�������Ӧ�Σ���ͼ��ʾ��

д�� V2O5��SO3�μӷ�Ӧ��Ļ�ѧ����ʽ_____��
(2)�� 2molSO2�� 1molO2�����ܱ������У���һ�������·�����Ӧ��2SO2(g)+O2(g)2SO3(g)��ƽ��ʱ SO3���������(% )���¶Ⱥ�ѹǿ�ı仯�����ʾ��
1.0 | 2.0 | 3.0 | |
350 | 54.0 | a | b |
415 | c | 40.0 | d |
550 | e | f | 36.0 |
�����ж���ȷ����______________
A.b >e
B.415�桢2.0MPaʱO2��ת����Ϊ60%
C.��һ���¶Ⱥ�ѹǿ�£����� V2O5�������ܼӿ췴Ӧ���ʣ���� SO3 ���������
D.ƽ�ⳣ�� K(550��)>K(350��)
(3)�ϴ��� SO2��������ԭ��ط��������ᡣͼ�����ӽ���Ĥ��___________���ӽ���Ĥ(����������������)
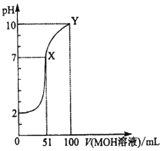
(4)�о����ֺ���ʽ����������Һ��SO2 ��ϵķ�ʽ��2�֣���һ������Һ�е�ˮ��ϡ���������ʽ�������еĻ���Al2O3��ϣ�ͨ����ȼƲⶨ����Һ��pH�仯�������ͼ��ʾ��

�����������ͼ�仯��ԭ��____
(5)ȡ��ȷ�SO3���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�������Ӧ��3SO3(g)(SO3)3(g) ��H<0����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��SO3�İٷֺ��������������淴Ӧ�¶�(T)�仯�Ĺ�ϵͼ������ʾ��ͼ�У�������ʵ�����������________________
A.  B.
B.  C.
C.  D.
D. 
(6)�� Na2SO3 ��Һ��Ϊ����Һ���� SO2 ʱ������Ϊ NaHSO3����֪���������������ƽ�ⳣ���ֱ�Ϊ K a1��K a2�������� NaHSO3��Һ�����Եij�Ҫ����Ϊ_____��(�ú�Ϊ Ka1��Ka2 �Ĵ���ʽ��ʾ)