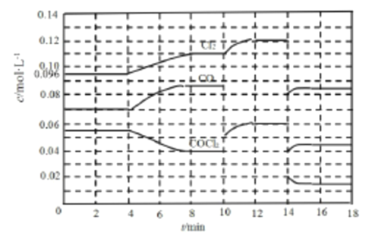
题目内容
【题目】已知相同温度下CH3COOH和NH3H2O的电离常数相等,现向10mL浓度为0.1molL﹣1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.c(NH4+):c(NH3H2O)始终减小
C.c(CH3COOH)与c(CH3COO)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO﹣)
【答案】BD
【解析】
A. 酸溶液、碱溶液抑制了水的电离,溶液显示中性前,随着氨水的加入,溶液中氢离子浓度逐渐减小,水的电离程度逐渐增大;当氨水过量后,随着溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小,所以滴加过程中,水的电离程度先增大后减小,故A错误;
B. 当向CH3COOH溶液中滴加相同浓度的氨水,开始时溶液为CH3COOH和CH3COO NH4的混合物,由CH3COONH4的水解常数Kh=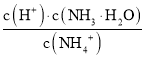 ,随着氨水的加入,c(H+)逐渐减小,Kh不变,则
,随着氨水的加入,c(H+)逐渐减小,Kh不变,则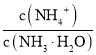 变小,当加氨水至溶液显碱性时,氨水的电离常数Kb=
变小,当加氨水至溶液显碱性时,氨水的电离常数Kb=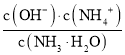 ),c(OH)与氢离子浓度成反比,随着氨水的滴入,氢氧根离子浓度逐渐增大,电离常数K不变,所以
),c(OH)与氢离子浓度成反比,随着氨水的滴入,氢氧根离子浓度逐渐增大,电离常数K不变,所以 逐渐减小,所以
逐渐减小,所以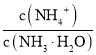 始终减小,故B正确;
始终减小,故B正确;
C. n(CH3COOH)与n(CH3COO)之和为0.001mol,始终保持不变,由于溶液体积逐渐增大,所以c(CH3COOH)与c(CH3COO)之和逐渐减小,故C错误;
D. 当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH),根据电荷守恒可知:c(NH4+)=c(CH3COO),故D正确;
故选:BD。

练习册系列答案
相关题目