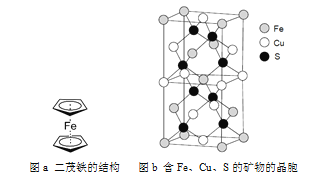
题目内容
【题目】水合草酸亚铁(FeC2O4·xH2O)在制药工业上有广泛应用。以莫尔盐[(NH4)2SO4·FeSO4·6H2O]为原料制备FeC2O4·xH2O,并探究其性质。回答下列问题:
已知:草酸亚铁晶体为淡黄色粉末,难溶于水,溶于稀酸;pH>4时,Fe2+容易被氧化。
I.制备FeC2O4·xH2O(如图)
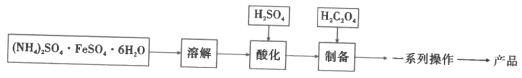
(1)加入H2SO4的目的是__。
(2)制备步骤的离子方程式是__。
(3)一系列操作是__。
II.探究FeC2O4·xH2O的分解产物:CO2、CO(如图)
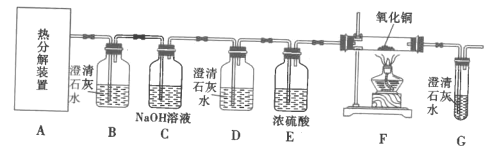
(4)装置D的作用是__,证明分解产物中存在CO的现象是__。
(5)从绿色化学角度考虑,实验存在不足之处,指出并提出解决方案:__。
III.定量测定FeC2O4·xH2O的化学式[M(FeC2O4)=144]
操作步骤:准确称取mg草酸亚铁晶体,溶于V1mL、c1mol·L-1的H2SO4溶液中,加热,用KMnO4标准溶液滴定至终点,加入锌粉将Fe3+恰好全部还原为Fe2+,然后用c2mol·L-1KMnO4标准溶液滴定至终点,记录消耗KMnO4标准溶液的体积为V2mL。
(6)第二次使用KMnO4标准溶液滴定的离子方程式为__。
(7)x=_(用字母表示)。
【答案】降低pH,防止Fe2+被氧化和水解 Fe2++H2C2O4+xH2O=FeC2O4·xH2O+2H+ 过滤,洗涤,干燥 检验CO2是否已除尽 F中生成红色固体,G中澄清石灰水变浑浊 有毒的CO尾气未处理,G后接酒精灯点燃或吸收CO的尾气处理装置 5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O ![]()
【解析】
Ⅰ.莫尔盐[(NH4)2SO4·FeSO4·6H2O]溶于水后溶液中存在NH4+、Fe2+、SO42-离子,Fe2+离子易水解且易被氧化,加入H2SO4酸化可以防止Fe2+离子被氧化和水解,与H2C2O4反应制得FeC2O4·xH2O;
Ⅱ.检验CO2、CO的混合物,需要先用B装置检验CO2的存在,用C装置中的NaOH溶液除去混合气体中的CO2,用D装置检验CO2是否除尽,防止对后续实验造成干扰,E装置干燥气体,通过F和G装置的实验现象检验CO的存在;
Ⅲ.第一次加入高锰酸钾后,将Fe2+和C2O42-氧化成Fe3+和CO2,加入锌粉还原Fe3+后,第二次加入高锰酸钾仅氧化Fe2+。
Ⅰ.莫尔盐[(NH4)2SO4·FeSO4·6H2O]溶于水后溶液中存在NH4+、Fe2+、SO42-离子,Fe2+离子易水解且易被氧化,加入H2SO4酸化可以防止Fe2+离子被氧化和水解,与H2C2O4反应制得FeC2O4·xH2O;
(1)根据题目信息可得,加入H2SO4的目的是降低pH,防止Fe2+被氧化和水解;
(2)制备步骤的离子方程式是Fe2++H2C2O4+xH2O=FeC2O4·xH2O+2H+;
(3)一系列的操作是将FeC2O4·xH2O分离提纯的过程,由于难溶于水,则需要过滤,洗涤,干燥得到产品;
Ⅱ.检验CO2、CO的混合物,需要先用B装置检验CO2的存在,用C装置中的NaOH溶液除去混合气体中的CO2,用D装置检验CO2是否除尽,防止对后续实验造成干扰,E装置干燥气体,通过F和G装置的实验现象检验CO的存在;
(4)装置D的作用是检验CO2是否已除尽,若存在CO,CO与F中氧化铜反应生成单质铜和CO2,G中澄清石灰水变浑浊;
(5)CO有毒,该实验没有尾气处理装置,应该在G后用酒精灯点燃或接吸收CO的尾气处理装置;
Ⅲ.第一次加入高锰酸钾后,将Fe2+和C2O42-氧化成Fe3+和CO2,加入锌粉还原Fe3+后,第二次加入高锰酸钾仅氧化Fe2+;
(6)第二次使用KMnO4标准溶液滴定的离子方程式为5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;
(7)由化学方程式中各物质的物质的量关系可得:

![]() =
=![]()
解得x=![]() 。
。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】研究水体中碘的存在形态及其转化是近年的科研热点。I-与I2在水体和大气中的部分转化如下图所示。
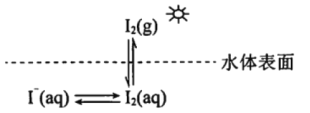
(1) I2的电子式为______________。
(2)水体中的I-在非酸性条件下难于被空气中的![]() 氧化。原因是
氧化。原因是![]() 的反应速率慢,反应程度小。
的反应速率慢,反应程度小。
①I-在酸性条件下与![]() 反应的离子方程式是_____________________________________。
反应的离子方程式是_____________________________________。
②在酸性条件下I-易被![]() 氧化的可能的原因是______________________________________。
氧化的可能的原因是______________________________________。
(3)有资料显示:水体中若含有![]() ,会对
,会对![]() 氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的
氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的![]() 通入到
通入到![]() 下列试剂中,一段时间后,记录实验现象与结果。己知:每
下列试剂中,一段时间后,记录实验现象与结果。己知:每![]() 参与反应,生成
参与反应,生成![]() 。
。
序号 | 试剂组成 | 反应前溶液的 | 反应后溶液的 |
|
|
甲 |
| 5.3 | 11.0 | 约10% | |
乙 |
| 5.1 | 4.1 | 约100% | 大量 |
丙 |
| 5.2 | 3.5 | —— | 少量 |
①![]() _______________________。
_______________________。
②甲中反应为可逆反应,其离子方程式是________________________。
③比较甲、乙、丙实验,说明![]() 在实验乙中的作用并解释_______________________。
在实验乙中的作用并解释_______________________。