题目内容
7.(1)在A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比1:1或2:1形成化合物,但常温时A、B形成化合物与C、B形成化合物的状态不同.D的原子最外层电子数最多,E是良好半导体,D和E能形成气态物质ED4.①C与B按原子个数比1:1形成化合物的电子式是
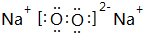 .
.②写出工业上制E单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(2)一定体积的密闭容器中,进行如下化学反应:
M(g)+3N(g)?2P(g)+Q(s)△H,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | … |
| K/(mol/L)-2 | 4×106 | 8×107 | … |
①判断该反应的△H> 0(填“>”或“<”)
②在一定条件下.能判断该反应一定达到化学平衡状态的是CD(填代号)
A.3v正(N)═2v逆(P) B.M 和N的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2,已知:
2CO(g)+O2(g)═2CO2(g)△H=-556kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
①写出CO和H2O(g)作用生成CO2和H2的热化学方程式:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-36.2kJ•mol-1
②H2是一种理想的绿色能源,可作燃料电池,该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是H2+2OH--2e-=2H2O
(4)在含有相同浓度Cl-和I-离子的溶液中,逐滴加入AgNO3溶液时,I-离子首先沉淀析出,当第二种离子开始沉淀时Cl-和I-的浓度子比为10-6:1.
(已知Ksp(AgI)═1.5×10-16,Ksp(AgCl)═1.56×10-10)
分析 (1)在A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比1:1或2:1形成化合物,但常温时A、B形成化合物与C、B形成化合物的状态不同,可推知A为H元素、B为O元素、C为Na;D的原子最外层电子数最多,E是良好半导体,D和E能形成气态物质ED4,则D为Cl、E为Si;
(2)①由表中数据可知,升高温度平衡常数增大,说明升高温度平衡向正反应方向移动;
②可逆反应到达平衡时,正逆反应速率相等,反应混合物各组分的含量、浓度不变,由此衍生的其它一些物理量不变,判断平衡状态的物理量应随反应进行发生变化,该物理量由变化到不变化,说明到达平衡;
(3)①根据盖斯定律,由已知热化学方程式乘以合适的系数进行加减构造目标热化学方程式;
②负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水;
(4)根据Ksp判断Cl-和I-离子沉淀时需要Ag+浓度大小,需要Ag+浓度越小的离子最先沉淀析出;溶液中Ag+浓度相等,由溶度积常数可知Cl-和I-的浓度子比为.
解答 解:(1)在A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比1:1或2:1形成化合物,但常温时A、B形成化合物与C、B形成化合物的状态不同,可推知A为H元素、B为O元素、C为Na;D的原子最外层电子数最多,E是良好半导体,D和E能形成气态物质ED4,则D为Cl、E为Si.
①C与B按原子个数比1:1形成化合物为Na2O2,电子式是 ,故答案为:
,故答案为: ;
;
②工业上制Si单质的化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(2)①由表中数据可知,升高温度平衡常数增大,说明升高温度平衡向正反应方向移动,则正反应为吸热反应,即△H>0,故答案为:>;
②A.3v正(N)═2v逆(P)时同种物质的正逆速率不相等,反应未到达平衡,故A错误;
B.M 和N的转化率相等不能说明到达平衡,与物质的起始物质的量有关,故B错误;
C.随反应进行容器内压强减小,当容器内压强保持不变时反应到达平衡 故C正确;
D.随反应进行容器内混合气体的质量减小,混合气体的密度保持不变,说明反应到达平衡,故D正确,
故选:CD;
(3)①已知:①2CO(g)+O2(g)═2CO2(g)△H=-556kJ•mol-1
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
根据盖斯定律,(①-②)×$\frac{1}{2}$可得:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-36.2kJ•mol-1,
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-36.2kJ•mol-1;
②负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:H2+2OH--2e-=2H2O,
故答案为:H2+2OH--2e-=2H2O;
(4)Cl-开始沉淀需要Ag+浓度=$\frac{1.56×1{0}^{-10}}{c(C{l}^{-})}$,I-离子沉淀时需要Ag+浓度=$\frac{1.5×1{0}^{-16}}{c({I}^{-})}$,由于Cl-和I-离子浓度相等,故I-离子沉淀时需要Ag+浓度较小,则I-离子先沉淀析出;
溶液中Ag+浓度相等,由溶度积常数可知Cl-和I-的浓度子比为Ksp(AgCl):Ksp(AgI)=1.56×10-10:1.6×10-16≈10-6:1,
故答案为:I-;10-6:1.
点评 本题考查结构性质位置关系、平衡常数影响元素、化学平衡状态判断、热化学方程式、电极反应式、溶度积的应用及计算等,属于拼合型题目,需要学生具备知识的基础.

| A. | 将Ba(OH)2•8H2O晶体与NH4Cl晶体混合搅拌,有氨气放出 | |
| B. | 甲烷燃烧 | |
| C. | 锌与稀硫酸反应产生H2 | |
| D. | 稀硫酸和NaOH的中和反应 |
| A. | 氢氧化铁溶液与盐酸的反应 OH?-+H+=H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2? |
| A. | Al3+ Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ NH4+ SO42- NO3- |
| A. | O2和H2的混合气体 | B. | 1.12L H2 | ||
| C. | 大于1.12L H2 | D. | 小于1.12L气体 |
 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.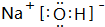 CB2的电子式为
CB2的电子式为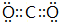
 已知A、B、C、D、E、F、G为前四周期七种元素且原子序数依次增大,其中A的基态原子中没有成对电子,B的基态原子中有6种不同运动状态的电子,C原子核外成对电子数比未成对电子数多1,其氢化物常用作制冷剂,D原子中有2个未成对电子,E基态原子在同周期中原子半径最大,F原子价电子排布为nsn-1nPn+1,G基态原子核外所有轨道都处于全满状态且属ds区的元素.
已知A、B、C、D、E、F、G为前四周期七种元素且原子序数依次增大,其中A的基态原子中没有成对电子,B的基态原子中有6种不同运动状态的电子,C原子核外成对电子数比未成对电子数多1,其氢化物常用作制冷剂,D原子中有2个未成对电子,E基态原子在同周期中原子半径最大,F原子价电子排布为nsn-1nPn+1,G基态原子核外所有轨道都处于全满状态且属ds区的元素.