题目内容
17.可以确定下列化学反应是吸热反应的是( )| A. | 将Ba(OH)2•8H2O晶体与NH4Cl晶体混合搅拌,有氨气放出 | |
| B. | 甲烷燃烧 | |
| C. | 锌与稀硫酸反应产生H2 | |
| D. | 稀硫酸和NaOH的中和反应 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:A.Ba(OH)2•8H2O晶体与NH4Cl晶体混合搅拌,有氨气放出是吸热反应,故A正确;
B.甲烷燃烧是放热反应,故B错误;
C.锌与稀硫酸反应是放热反应,故C错误;
D.氢氧化钠溶液和盐酸反应是中和反应,是放热反应,故D错误.
故选A.
点评 本题考查化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.在2L密闭容器中,发生反应2A+B=2C+D,若最初A、B都是8mol,在前10s 内A 的平均速率为0.24mol/(L?s),则10s时B的物质的量是( )
| A. | 2.4mol | B. | 3.2mol | C. | 4.8mol | D. | 5.6mol |
8.根据有机物CH2=CH-CH2OH的结构推测,它不可能具有的性质是( )
| A. | 能与NaOH反应 | B. | 能与乙酸反应 | C. | 能与溴水反应 | D. | 能与钠反应 |
12.下列过程属于物理变化的是( )
| A. | 海水淡化 | B. | 石油裂化 | C. | 煤的干馏 | D. | 煤的气化 |
6.常温下,下列变化过程不是自发的是( )
| A. | 原电池产生电流 | B. | 石灰石的分解 | ||
| C. | 在密闭条件下体系从有序变为无序 | D. | Ba(OH)2•8H2O与NH4Cl的反应 |
7.(1)在A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比1:1或2:1形成化合物,但常温时A、B形成化合物与C、B形成化合物的状态不同.D的原子最外层电子数最多,E是良好半导体,D和E能形成气态物质ED4.
①C与B按原子个数比1:1形成化合物的电子式是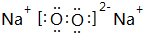 .
.
②写出工业上制E单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(2)一定体积的密闭容器中,进行如下化学反应:
M(g)+3N(g)?2P(g)+Q(s)△H,其化学平衡常数K与温度t的关系如下表:
请完成下列问题:
①判断该反应的△H> 0(填“>”或“<”)
②在一定条件下.能判断该反应一定达到化学平衡状态的是CD(填代号)
A.3v正(N)═2v逆(P) B.M 和N的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2,已知:
2CO(g)+O2(g)═2CO2(g)△H=-556kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
①写出CO和H2O(g)作用生成CO2和H2的热化学方程式:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-36.2kJ•mol-1
②H2是一种理想的绿色能源,可作燃料电池,该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是H2+2OH--2e-=2H2O
(4)在含有相同浓度Cl-和I-离子的溶液中,逐滴加入AgNO3溶液时,I-离子首先沉淀析出,当第二种离子开始沉淀时Cl-和I-的浓度子比为10-6:1.
(已知Ksp(AgI)═1.5×10-16,Ksp(AgCl)═1.56×10-10)
①C与B按原子个数比1:1形成化合物的电子式是
 .
.②写出工业上制E单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(2)一定体积的密闭容器中,进行如下化学反应:
M(g)+3N(g)?2P(g)+Q(s)△H,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | … |
| K/(mol/L)-2 | 4×106 | 8×107 | … |
①判断该反应的△H> 0(填“>”或“<”)
②在一定条件下.能判断该反应一定达到化学平衡状态的是CD(填代号)
A.3v正(N)═2v逆(P) B.M 和N的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2,已知:
2CO(g)+O2(g)═2CO2(g)△H=-556kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
①写出CO和H2O(g)作用生成CO2和H2的热化学方程式:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-36.2kJ•mol-1
②H2是一种理想的绿色能源,可作燃料电池,该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是H2+2OH--2e-=2H2O
(4)在含有相同浓度Cl-和I-离子的溶液中,逐滴加入AgNO3溶液时,I-离子首先沉淀析出,当第二种离子开始沉淀时Cl-和I-的浓度子比为10-6:1.
(已知Ksp(AgI)═1.5×10-16,Ksp(AgCl)═1.56×10-10)
 Fe(OH)3+3H+(用适当的文字和离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为:
Fe(OH)3+3H+(用适当的文字和离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为: