题目内容
7.某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下.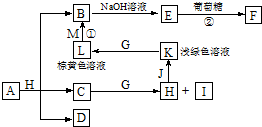
提出猜想:
问题1:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题2:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
Ⅰ.解决问题1取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在.根据以上实验现象回答问题.
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:Cu2O+2H+=Cu+Cu2++H2O,
(2)从实验Ⅰ可得出的结论是高温时,+1价的铜比+2价的铜稳定,而溶液中,+2价的铜比+1价的铜稳定
Ⅱ.解决问题2
设计如下装置(夹持装置未画出):
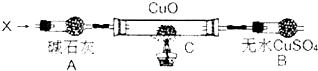
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01mol X,测得B装置增重0.36g,并收集到0.28g单质气体Y.
(1)X气体的摩尔质量是32g/mol.
(2)C中发生反应的化学方程式为2CuO+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2↑+2H2O.
分析 Ⅰ.问题1:铁和铜都有变价,具有相似点,正二价铁的稳定性小于正三价的铁,探究正一价铜的稳定性是否也小于正二价的铜,解决问题取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末,继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜,说明高温时,+1价的铜比+2价的铜稳定,取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),Cu2O+2H+=Cu2++Cu+H2O得到蓝色溶液,同时观察到试管底部还有红色固体存在,说明溶液中,+2价的铜比+1价的铜稳定.
(1)根据信息:红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液为+2价的铜盐溶液,同时观察到试管底部还有红色固体存在为铜单质,据此书写化学方程式;
(2)根据信息:氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末为氧化铜;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜,说明高温+1价铜稳定;
Ⅱ.A中碱石灰可吸收水蒸气,C中N2H4和氧化铜反应:2CuO+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2↑+2H2O,无水硫酸铜遇水变蓝,可检验水,吸收水,B装置增重0.36g,即生成0.02mol的水,单质气体Y为氮气.
(1)根据原子守恒确定气态氢化物的化学式,计算摩尔质量;
(2)根据实验现象来书写化学方程式.
解答 解:Ⅰ.问题1:铁和铜都有变价,具有相似点,正二价铁的稳定性小于正三价的铁,探究正一价铜的稳定性是否也小于正二价的铜,解决问题取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末,继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜,说明高温时,+1价的铜比+2价的铜稳定,取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),Cu2O+2H+=Cu2++Cu+H2O得到蓝色溶液,同时观察到试管底部还有红色固体存在,说明溶液中,+2价的铜比+1价的铜稳定.
(1)根据信息:红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液为+2价的铜盐溶液,同时观察到试管底部还有红色固体为铜单质,Cu2O中+1价的铜在酸性溶液中发生氧化还原反应:Cu2O+2H+=Cu+Cu2++H2O,
故答案为:Cu2O+2H+=Cu+Cu2++H2O;
(2)根据信息:氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜,根据在不同温度下反应物的组成可确定物质的稳定性,所以高于1000℃时Cu2O比CuO稳定,在溶液中:Cu2O+2H+=Cu+Cu2++H2O,所以Cu2+比Cu+稳定,
故答案为:高温时,+1价的铜比+2价的铜稳定,而溶液中,+2价的铜比+1价的铜稳定;
Ⅱ.(1)消耗0.01mol X,测得B装置增重0.36g,即生成0.02mol的水,并收集到单质气体Y 0.28g即氮气0.01mol,根据原子守恒可以确定气态氢化物X中含有4个氢原子和2个氮原子,X的化学式为N2H4,其摩尔质量为32g/mol,
故答案为:32g/mol;
(2)C中发生反应的化学方程式为N2H4和氧化铜反应:2CuO+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2↑+2H2O,
故答案为:2CuO2CuO+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2↑+2H2O.
点评 本题考查实验探究和数据处理,做题时注意变价金属氧化物的性质以及质量守恒定律计算物质的化学式.题目难度中等.

| A. | 0.1mol/L | B. | 0.25mol/L | C. | 1mol/L | D. | 1.5mol/L |
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 原电池工作时,阳离子向负极方向移动 | |
| C. | 反应Cu+2H+=Cu2++H2↑可设计成原电池装置 | |
| D. | 锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率 |
| A. | 氢气与氧气化合生成液态水 | B. | 氯化钠固体溶于水 | ||
| C. | 氧化铁变成Fe2O3 | D. | 水由气态变为液态 |
N2(g)+3H2(g)?2NH3(g)△H<0
(1)若在5min时反应达到平衡,此时测得NH3的物质的量为4mol.则前5min的平均反应速率v(N2)=0.2mol/(L•min).平衡时H2的转化率为50%.该温度下的平衡常数K1=$\frac{4}{27}$(用分数表示);若反应开始时,将1molN2和3molH2通入到该容器,再达新平衡时的平衡常数为K2,则K2=K1(填“>”、“<”或“=”)
(2)平衡后,若要提高H2的转化率,可以采取的措施有C.
A.加了催化剂B.充入一定量的Ne
C.降低反应体系的温度D.再充入2mol的Ne和6mol的H2
(3)其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“>”、“<”或“=”).
②400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数为2,2L的容器中,当测得NH3、N2和H2物质的量分别为6mol、4mol和2mol时,则该反应的v(N2)减>v(N2)增(填“>”、“<”或“=”).
(4)根据化学反应速率和化学平衡理论,联合合成氨的生产实际,你认为下列说法不正确的是C
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
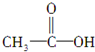 ,(请书写结构简式)则红外光谱中应该有4个振动吸收;核磁共振氢谱中应该有2个峰.
,(请书写结构简式)则红外光谱中应该有4个振动吸收;核磁共振氢谱中应该有2个峰.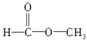 ,(请书写结构简式)则红外光谱中应该有3个振动吸收;核磁共振氢谱中应该有2个峰.
,(请书写结构简式)则红外光谱中应该有3个振动吸收;核磁共振氢谱中应该有2个峰.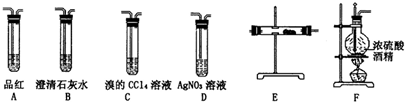 某研究小性学习小组的同学欲用如图所示的装置完成下列实验,验证制得的乙烯气体中含有SO2、CO2、水蒸气;确定乙烯与单质溴能否反应及反应类型.
某研究小性学习小组的同学欲用如图所示的装置完成下列实验,验证制得的乙烯气体中含有SO2、CO2、水蒸气;确定乙烯与单质溴能否反应及反应类型.