题目内容
16.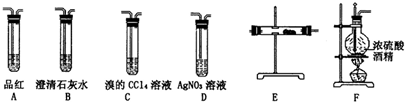 某研究小性学习小组的同学欲用如图所示的装置完成下列实验,验证制得的乙烯气体中含有SO2、CO2、水蒸气;确定乙烯与单质溴能否反应及反应类型.
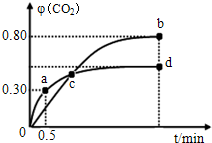
某研究小性学习小组的同学欲用如图所示的装置完成下列实验,验证制得的乙烯气体中含有SO2、CO2、水蒸气;确定乙烯与单质溴能否反应及反应类型.(1)写出生成上述无机副产物的化学方程式C+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CO2↑+2SO2↑+2H2O.
(2)为实现上述目的,装置连接的预期顺序(各装置限用一次)为FA→B→E→CD.
(3)实验中,混合浓硫酸与乙醇的方法是浓硫酸慢慢加到另一种物质中;加热F装置时必须使液体温度170℃.
(4)验证有CO2生成的装置中产生的现象是澄清石灰水变浑浊,有同学通过分析安装后的实验装置构成后认为,仅由该装置内现象无法确定生成物中是否含有CO2,该同学作出此判断的依据是SO2也能使澄清石灰水变浑浊.
(5)改进装置设计中可能存在的所有缺陷后,当C中现象为溴的四氯化碳溶液颜色会逐渐褪色,表明单质溴要与乙烯反应;若D中溶液有淡黄色沉淀表明C中发生的是取代反应;若D没有出现前面所描述的现象时,表明C中发生的是加成反应.
分析 本题是以乙醇与浓硫酸混合加热至170℃制乙烯为载体,探究乙烯与溴反应原理,因浓硫酸的强氧化性和脱水性,制乙烯的同时有副产物SO2、CO2生成,因SO2的还原性影响乙烯与溴的加成反应,故需要先除溴和CO2,再验证乙烯与溴的反应,具体流程是先利用A中NaOH溶液吸收SO2和CO2,并用B装置中的澄清石灰水检验两气体是否完全除去,再利用E装置进行干燥,最后通入C装置与溴反应,并结合D中硝酸银溶液验证反应原理,据此可作答;
(1)因浓硫酸的脱水性,乙醇与浓硫酸混合后有少量碳生成,碳再浓硫酸混合加热得到SO2和CO2,结合质量守恒可写出此反应的化学方程式;
(2)根据实验目的及题干信息,应该先用氢氧化钠溶液除去SO2、CO2,再用澄清石灰水检验杂质是否除尽,然后用浓硫酸干燥乙烯,再用溴的四氯化碳溶液检验乙烯的性质,用D检验是否有溴化氢生成从而判断乙烯与溴的反应类型;
(3)类比浓硫酸的稀释方法解答,即应该将浓硫酸加入乙醇中,乙醇与浓硫酸混合加热制乙烯的温度是170℃;
(4)CO2能使澄清石灰水变浑浊,可利用B中澄清石灰水检验,混合气体中SO2也能使澄清石灰水变浑浊;
(5)溴的四氯化碳溶液显红棕色,如果乙烯能与溴反应,随着反应的进行,消耗的溴越来越多,溶液的颜色会变浅直至褪色,如果乙烯与溴发生加成反应,C中无气体逸出,如果发生取代反应,只会有HBr气体生成进入D中,可结合反应的现象判断.
解答 解:(1)因浓硫酸的强氧化性,乙醇脱水生成的碳和浓硫酸反应的化学方程式为C+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)为得到纯净的乙烯,应用NaOH溶液除去SO2、CO2,(并用石灰水检验是否除尽),然后用硫酸铜粉末或CaCl2干燥;乙烯与单质溴之间可能发生加成反应,也可能发生取代反应,若是取代反应,则会有HBr生成,HBr与AgNO3溶液反应会产生浅黄色沉淀,所以装置连接顺序为:F→A→B→E→C→D,故答案为:A→B→E→C;
(3)浓硫酸密度大于乙醇,且混合过程中放热大量热,所以应该将浓硫酸加入乙醇中,混合加热到170℃时有乙烯生成,故答案为:浓硫酸;170℃;
(4)CO2遇澄清石灰水变浑浊,SO2也能使澄清石灰水变浑浊,因此无法确定生成物中一定有CO2,故答案为:澄清石灰水变浑浊;SO2也能使澄清石灰水变浑浊;
(5)乙烯与溴反应后,溴的四氯化碳溶液颜色会逐渐褪色,如果溴与乙烯发生的是取代反应,生成的溴化氢遇硝酸银溶液会生成淡黄色沉淀,如果发生的是加成反应,D中无现象,故答案为:溴的四氯化碳溶液颜色会逐渐褪色;淡黄色沉淀;加成.
点评 本题考查了乙烯的实验室制备和性质的检验,明确制备原理是解题关键,注意掌握乙醇的化学性质、乙烯性质及检验方法,题目难度不大.

| A. | 一定温度和压强下,将 0.5mo1N2和 1.5mo1H2 置于密闭容器中充分反应生成 NH3(g),放 热 19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |||||||||
| B. | H2 标准燃烧热△H=-285.8 kJ•mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1 | |||||||||
| C. | C(石墨)═C(金刚石)△H=+1.9kJ•mol-1,说明石墨比金刚石稳定 | |||||||||
| D. | 通常人们把拆开 1 mol 某化学键所吸收的能量看成该化学键的键能:
|
| A. | 肯定有NaNO3 | B. | 肯定有NaNO3,可能还含有K2CO3 | ||
| C. | 肯定没有Ba(NO3)2,可能有NaNO3 | D. | 肯定没有K2CO3和Ba(NO3)2 |
| A. | 氯化钠的电子式: | |
| B. | 过氧化钠的化学式:Na2O | |
| C. | Cl-的结构示意图: | |
| D. | 硫酸的电离方程式:H2SO4=2H++SO42- |
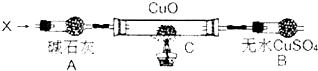
 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为: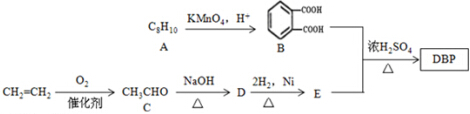

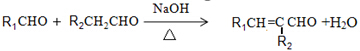
 .
. .
.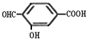 、
、 .
.