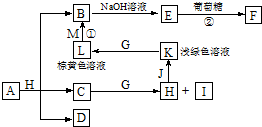
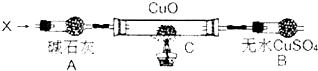
题目内容
17.分子式为C2H4O2的结构可能有2种,现对其结构进行物理方法鉴定:(1)若为
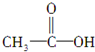 ,(请书写结构简式)则红外光谱中应该有4个振动吸收;核磁共振氢谱中应该有2个峰.
,(请书写结构简式)则红外光谱中应该有4个振动吸收;核磁共振氢谱中应该有2个峰.(2)若为
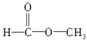 ,(请书写结构简式)则红外光谱中应该有3个振动吸收;核磁共振氢谱中应该有2个峰.
,(请书写结构简式)则红外光谱中应该有3个振动吸收;核磁共振氢谱中应该有2个峰.
分析 通过红外光谱法可知分子中成键特点和官能团,通过核磁共振氢谱法可以知道分子中含有几种环境的氢;
根据结构简式中的化学键和官能团判断;根据有机物中氢原子的种类数判断.
解答 解:C2H4O2的可能是羧酸或酯,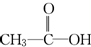 或
或 ,故答案为:2;
,故答案为:2;
(1)若为 ,该有机物中有
,该有机物中有 H,则红外光谱中应该有4个振动吸收;分子中含“-CH3”、“-OH”两类氢,则在核磁共振氢谱上有2个峰;
H,则红外光谱中应该有4个振动吸收;分子中含“-CH3”、“-OH”两类氢,则在核磁共振氢谱上有2个峰;
故答案为: ;4;2;
;4;2;
(2)若为 ,该有机物中有
,该有机物中有 ,则红外光谱中应该有3个振动吸收;分子中含有2种氢原子,则在核磁共振氢谱上有2个峰;
,则红外光谱中应该有3个振动吸收;分子中含有2种氢原子,则在核磁共振氢谱上有2个峰;
故答案为: ;3;2.
;3;2.
点评 本题考查了有机物结构的鉴定,题目难度不大,注意把握红外光谱法、核磁共振氢谱的判断方法.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
5.下列有关实验的叙述,正确的是(填序号) ( )
| A. | 用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液 | |
| B. | 分馏石油时,温度计的末端必须插入液面下 | |
| C. | 用分液漏斗分离环己烷和水的混合液体 | |
| D. | 用浓氨水洗涤做过银镜反应的试管 | |
| E. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止 |
12.下列饮食习惯科学的是( )
| A. | 人类需要的蛋白质可由鸡蛋提供,多吃有益 | |
| B. | 为防止变胖,炒菜时不放油 | |
| C. | 合理摄入糖类、油脂等,注意膳食平衡 | |
| D. | 淀粉、油脂、蛋白质为人体提供热能,只要这三种摄入量足够就可以 |
2.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 将足量CO2通入:NH4+、Na+、Al3+、NO${\;}_{3}^{-}$ | |
| B. | 在中性的水溶液中:Fe2+、K+、NO${\;}_{3}^{-}$、ClO- | |
| C. | 含有大量Al3+的溶液中:Na+、NO3-、Cl-、AlO2- | |
| D. | 水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Mg2+、HCO3-、SO${\;}_{4}^{2-}$ |
9.下列关于乙酸的说法中错误的是( )
| A. | 食醋中乙酸含量为3~5g/100mL | B. | 与HCOOCH3互为同分异构体 | ||
| C. | 可用分液法分离乙酸和水 | D. | 能与碳酸钠溶液反应 |
6.下列生活常见现象中,没有涉及化学变化的是( )
| A. |  光合作用 | B. |  炭烧取暖 | C. |  风力发电 | D. |  电解冶炼 |
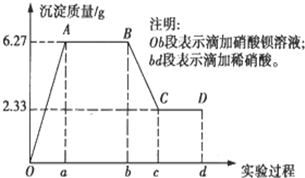 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加2mol/L的硝酸,实验过程中沉淀质量的变化情况如图所示:
某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加2mol/L的硝酸,实验过程中沉淀质量的变化情况如图所示: