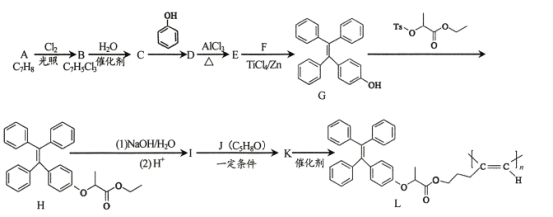
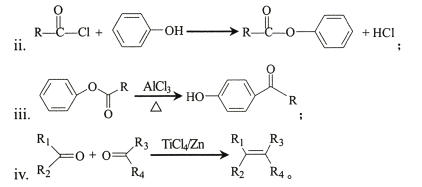
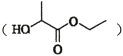
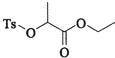
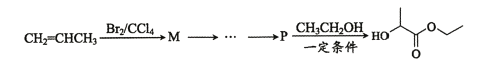
题目内容
【题目】下表是元素周期表的前四周期,请回答有关问题:(相关问题均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)④的原子结构示意图为_________;②在元素周期表位置________;上述元素中最高价氧化物的水化物酸性最强的是_________;(填水化物化学式)
(2)⑤的最高价氧化物的水化物和⑥的最高价氧化物反应的离子方程式________________
(3)用电子式表示元素①和⑧形成的化合物的形成过程________________
(4)⑤的最高价氧化物水化物的电子式________________
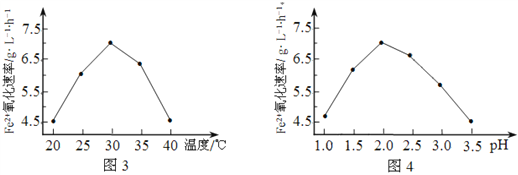
(5)请设计实验证明⑧与⑩的氧化性强弱________________
【答案】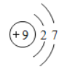 第二周期第ⅣA族 HClO4 Al2O3 + 2OH- = 2AlO2 -+ H2O
第二周期第ⅣA族 HClO4 Al2O3 + 2OH- = 2AlO2 -+ H2O ![]()
![]() 将Cl2通入NaBr溶液中,溶液变橙黄色,说明Cl2置换出溴,从而证明Cl的氧化性强于Br
将Cl2通入NaBr溶液中,溶液变橙黄色,说明Cl2置换出溴,从而证明Cl的氧化性强于Br
【解析】
根据元素在元素周期表中的位置可知①为H元素,②为C元素,③为N元素,④为F元素,⑤为Na元素,⑥为Al元素,⑦为S元素,⑧为Cl元素,⑨为K元素,⑩为Br元素。
(1)④为F元素,F是9号元素,原子结构示意图为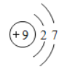 ;②为C元素,是第6号元素,周期表中位于第二周期第ⅣA族;最高价氧化物的水化物酸性越强,非金属性越强,表中非金属性最强的是F,但F没有最高价含氧酸,所以剩余元素中Cl元素非金属性最强,其最高价氧化物HClO4是酸性最强的含氧酸;
;②为C元素,是第6号元素,周期表中位于第二周期第ⅣA族;最高价氧化物的水化物酸性越强,非金属性越强,表中非金属性最强的是F,但F没有最高价含氧酸,所以剩余元素中Cl元素非金属性最强,其最高价氧化物HClO4是酸性最强的含氧酸;
(2)⑤的最高价氧化物的水化物是NaOH,⑥的最高价氧化物是Al2O3,反应方程式为:Al2O3+ 2OH- = 2AlO2 -+ H2O;
(3)H与Cl形成的HCl是共价化合物,其形成过程可表示为:![]() ;
;
(4)⑤的最高价氧化物水化物是NaOH,为离子化合物,其电子式为![]() ;
;
(5)比较Cl与Br的氧化性强弱可以通过置换反应,Cl2能将NaBr中的Br2置换出来,则证明Cl的氧化性强于Br;

【题目】砷化镓(GaAs)灯泡寿命是普通灯泡的100倍,而耗能即为10%,推广砷化镓(GaAs)、 氮化镓(GaN)等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:
(1)基态N原子核外电子排布图为 _____________________ ;Ga与Al同主族,且位于Al的下一周期,则基态Ga原子的价电子排布式为 ________________。
(2)Ga的电负性比As______(填“大”或“小”);Ga逐级失去电子的电离能 (单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知Ga的主要化合价为__和+3。
(3)比较下列Ga的卤化物的熔点和沸点, GaCl3、GaBr3、GaI3的熔、沸点依次升高, 分析其变化的原因是:_____________________________________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是____________________________。
(4)GaAs是将(CH3)3Ga和AsH3用金属有机物化学气相淀积方法制备得到,该反应在700℃下进行
①则该反应的化学方程式为:____________________________________________。
②反应物AsH3分子的几何构型为________________,(CH3)3Ga中镓原子杂化方式为____________________。