题目内容
15.下列各溶液中,微粒的浓度关系式正确的是( )| A. | 0.1mol•L-1的Na2S溶液:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) | |
| B. | 常温下,pH=2的盐酸和pH=12的氨水等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1的NH4NO3溶液:c(NH4+)=c(NO3-) | |
| D. | 常温下,pH=3的H2SO3溶液:c(H+)=c(HSO3-)=1×10-5mol•L-1 |
分析 A.根据硫化钠溶液中的物料守恒分析;
B.氨水为弱碱,混合液中氨水过量,溶液显示碱性,c(OH-)>c(H+);
C.铵根离子部分水解,导致铵根离子浓度小于硝酸根离子;
D.常温下pH=3的H2SO3溶液中氢离子浓度为1×10-3mol•L-1,且亚硫酸为弱酸,溶液中部分电离出亚硫酸氢根离子和氢离子.
解答 解:A.0.1mol•L-1的Na2S溶液中,根据物料守恒可得:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S),故A正确;
B.常温下,pH=2的盐酸和pH=12的氨水等体积混合,氨水为弱碱,混合液中氨水过量,溶液显示碱性,则c(OH-)>c(H+),结合电荷守恒可得:c(NH4+)>c(Cl-),溶液中正确的离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故B错误;
C.0.1mol•L-1的NH4NO3溶液中,由于铵根离子部分水解,导致铵根离子的浓度减小,则:c(NH4+)<c(NO3-)=0.1mol•L-1,故C错误;
D.常温下pH=3的H2SO3溶液中氢离子浓度为1×10-3mol•L-1,亚硫酸为二元弱酸,则c(H+)=1×10-3mol•L-1>c(HSO3-),故D错误;
故选A.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,明确电荷守恒、物料守恒的含义为解答关键,B为易错点,注意氨水为弱碱,二者混合后氨水过量,混合液呈碱性.

练习册系列答案
相关题目
6.以CH2=CH2和CH2=CH-CH3混合物为单体,发生加聚反应,可能得到的是( )


| A. | ①② | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③④ |
10.饱和食盐水中加入碳酸氢铵可制备小苏打,滤出小苏打后,向母液中通入氨,再冷却、加食盐,过滤,得到氯化铵固体.下列分析错误的是( )
| A. | 该制备小苏打的方程式为:NaCl+NH4HCO3→NaHCO3↓+NH4Cl | |
| B. | 母液中通入的氨气与HCO3-反应:NH3+HCO3-→CO32-+NH4+ | |
| C. | 加食盐是为增大溶液中Cl-的浓度 | |
| D. | 由题可知温度较低时,氯化铵的溶解度比氯化钠的大 |
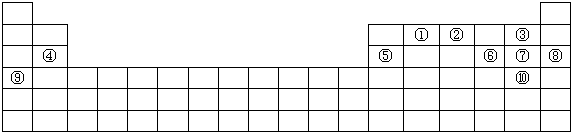
5.观察下列模型并结合有关信息,判断有关说法不正确的是( )
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结 构 模 型 示 意 图 |  |  |  |  |
| 备注 | 熔点1873K | 易溶于CS2 |
| A. | 单质硼属于原子晶体,结构单元中含有30个B-B键,含有20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8属于原子晶体 | |
| D. | HCN的结构式为H-C≡N |
 .
.
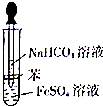 某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.

 、取代反应
、取代反应 、加聚反应
、加聚反应