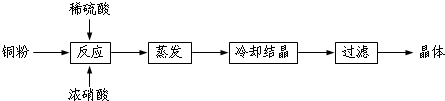
题目内容
4.写出下列反应的化学方程式,并指出反应类型(共4小问,化学方程式每个2分,反应类型每个1分,共12分):(1)溴苯的制备C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr、取代反应
(2)用甲苯制备TNT
 、取代反应
、取代反应(3)由丙烯制备聚丙烯
 、加聚反应
、加聚反应(4)1,2-二溴乙烷与其足量氢氧化钠的乙醇溶液加热:CH2BrCH2Br+2NaOH$\stackrel{乙醇△}{→}$CH≡CH↑+2NaBr+2H2O、消去反应.
分析 (1)苯与液溴在铁做催化剂条件下发生取代反应生成溴苯;
(2)甲苯和浓硝酸在浓硫酸催化剂作用下发生取代反应生成三硝基甲苯和水;
(3)丙烯发生加聚反应生成聚丙烯;
(4)1,2-二溴乙烷和氢氧化钠的乙醇溶液共热发生消去反应生成乙炔和溴化钠、水.
解答 解:(1)苯与液溴在铁做催化剂条件下发生取代反应生成溴苯,化学方程式为:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr,取代反应;
故答案为:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr;取代反应;
(2)甲苯可以和浓硝酸之间发生取代反应生成2,4,6-三硝基甲苯,即TNT,化学反应方程式为: ,属于取代反应;
,属于取代反应;
故答案为: ;取代反应;
;取代反应;
(3)丙烯能发生加聚反应得到聚丙烯,方程式为 ,属于加聚反应,
,属于加聚反应,
故答案为: ;加聚反应;
;加聚反应;
(4)1,2-二溴乙烷和氢氧化钠的乙醇溶液共热发生消去反应,反应的化学方程式为:CH2BrCH2Br+2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaBr+2H2O,
故答案为:CH2BrCH2Br+2NaOH$\stackrel{乙醇△}{→}$CH≡CH↑+2NaBr+2H2O,消去反应.
点评 本题考查了化学方程式的书写,侧重考查有机反应化学方程式书写,把握发生的化学反应及官能团与性质的关系为解答的关键,注意有机反应条件及反应类型,题目难度不大.

练习册系列答案
相关题目
1.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
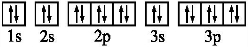
(1)溴的基态原子的价电子排布图为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘(I).
(4)已知高碘酸有两种形式,化学式分别为H5IO6(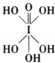 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于溶液中发生下列反应:I-+I2═I3-.I3-的中心原子周围的σ键电子对对数为2,孤电子对对数为3.
(6)写出一个CO2的等电子体:CS2、N2O.
(1)溴的基态原子的价电子排布图为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘(I).
| 元素名称 | 氟 | 氧 | 溴 | 碘 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于溶液中发生下列反应:I-+I2═I3-.I3-的中心原子周围的σ键电子对对数为2,孤电子对对数为3.
(6)写出一个CO2的等电子体:CS2、N2O.
15.下列各溶液中,微粒的浓度关系式正确的是( )
| A. | 0.1mol•L-1的Na2S溶液:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) | |
| B. | 常温下,pH=2的盐酸和pH=12的氨水等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1的NH4NO3溶液:c(NH4+)=c(NO3-) | |
| D. | 常温下,pH=3的H2SO3溶液:c(H+)=c(HSO3-)=1×10-5mol•L-1 |
19.已知O3在一定条件下能自发分解,相关反应为:2O3(g)═3O2(g)△H=-285kJ•mol-1.
反应历程为①O3═02+O(慢);②O3+O═2O2(快).下列说法正确的是:( )
反应历程为①O3═02+O(慢);②O3+O═2O2(快).下列说法正确的是:( )
| A. | 臭氧比氧气稳定 | B. | 臭氧分解的反应速率由步骤①决定 | ||
| C. | 反应的活化能等于285kJ•mol-1 | D. | 氧原子是该反应的催化剂 |
9.X、Y、Z均为短周期元素,X、Y同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子的最外层电子数:X>Y>Z | B. | 单质沸点:Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
13.对于Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H<0的化学反应下列叙述不正确的是( )
| A. | 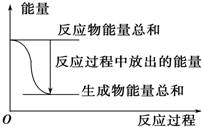 反应过程中能量关系可用如图表示 | |
| B. | △H的值与反应方程式的计量系数有关 | |
| C. | 若将该反应设计成原电池,锌为负极 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
14.乙醇分子中有各种化学键.如: 关于乙醇在下列各种反应中,对化学键断裂的说法正确的是( )
关于乙醇在下列各种反应中,对化学键断裂的说法正确的是( )
 关于乙醇在下列各种反应中,对化学键断裂的说法正确的是( )
关于乙醇在下列各种反应中,对化学键断裂的说法正确的是( )| A. | 乙醇跟钠反应时,化学键④断裂 | |
| B. | 乙醇在Cu作催化剂条件下生成乙醛的反应中,化学键①⑤断裂 | |
| C. | 乙醇跟浓H2SO4共热到170℃时,化学键①④断裂 | |
| D. | 乙醇跟醋酸、浓H2SO4共热时,化学键④断裂 |