题目内容
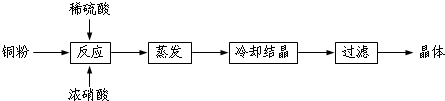
7.实验室可用NaClO3制取ClO2气体,再由ClO2制得NaClO2,实验装置如图所示:回答下列问题:
(1)仪器a的名称为圆底烧瓶;B中H2O2发生氧化反应(填“氧化”、“还原”或“非氧化还原”);装置C的作用是防止倒吸.
(2)该实验必须使NaClO3稍微过量,目的是使Na2SO3完全反应,避免产生SO2.
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意控制硫酸滴入速度.
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,则另一种为ClO3-.
(5)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入②(填序号,下同)酸化,再加入⑤⑥检验.
①稀HNO3 ②稀H2SO4 ③K2SO3溶液④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(6)25℃时,浓度均为0.1mol•L-1的NaClO2溶液和CH3COONa溶液,两溶液中c(CIO2->c(CH3COO-(填“>”“<”或“=”;已知HC1O2的电离常数为1.1×10-2mol•L-1,CH3COOH的电离常数为1.7×10-5mol•L-1)若要使两溶液的pH相等应bd(填序号)
a.向NaClO2溶液中加适量水
b.向NaClO2溶液中加适量NaOH固体
c.向CH3COONa溶液中加CH3COONa固体
d.向CH3COONa溶液中加适量的水.
分析 酸性条件下,NaClO3与亚硫酸钠反应生成ClO2,ClO2与双氧水在碱性条件下反应生成NaClO2,二氧化氯属于有毒气体,所以尾气用NaOH溶液处理;
(1)根据装置图判断仪器名称;ClO2与双氧水在碱性条件下反应生成NaClO2,根据化合价的变化判断;C瓶为空的试剂瓶可以防倒吸;
(2)根据反应方程式可知使一种反应物过量,则另一种反应物反应完全;
(3)缓慢通入ClO2可以使ClO2气体能被均匀、充分吸收;
(4)根据得失电子守恒判断;
(5)酸化溶液时一般用稀硫酸,检验氧化性的物质可以选用具有还原性的物质;
(6)酸性越弱,酸根离子水解程度越大;NaClO2溶液和CH3COONa溶液均显碱性,CH3COONa溶液碱性强,若要使两溶液的pH相等应减小CH3COONa溶液pH,或增大NaClO2溶液pH.
解答 解:酸性条件下,NaClO3与亚硫酸钠反应生成ClO2,ClO2与双氧水在碱性条件下反应生成NaClO2,二氧化氯属于有毒气体,所以尾气用NaOH溶液处理;
(1)根据装置图可知仪器a名称为圆底烧瓶;ClO2与双氧水在碱性条件下反应生成NaClO2,反应中Cl元素的化合价降低,作氧化剂,反应中双氧水中O元素的化合价升高,双氧水作还原剂,发生氧化反应;C瓶为空的试剂瓶作为安全瓶,可以防倒吸;
故答案为:圆底烧瓶;氧化;防止倒吸;
(2)根据反应方程式可知使一种反应物过量,则另一种反应物反应完全,所以该实验必须使NaClO3稍微过量,目的是使Na2SO3完全反应,避免产生SO2;
故答案为:使Na2SO3完全反应,避免产生SO2;
(3)缓慢通入ClO2可以使ClO2气体能被均匀、充分吸收,硫酸、NaClO3与亚硫酸钠反应生成ClO2,所以应该控制硫酸滴入速度;
故答案为:控制硫酸滴入速度;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,ClO2到ClO2-化合价降低1价,则ClO2生成的另一种产物中化合价应该升高1价,所以一种为ClO3-;
故答案为:ClO3-;
(5)酸化溶液时一般用稀硫酸,硝酸具氧化性,不能选用硝酸;检验氧化性的物质可以选用具有还原性的物质,所以检验NaClO2具有氧化性应该选用⑤FeCl2溶液 ⑥KSCN溶液;
故答案为:②;⑤⑥;
(6)酸性越弱,酸根离子水解程度越大,已知醋酸的电离常数小于HClO2,说明醋酸的酸性弱,所以醋酸根离子水解程度大,则醋酸根离子浓度小;NaClO2溶液和CH3COONa溶液均显碱性,CH3COONa溶液碱性强,若要使两溶液的pH相等,应减小CH3COONa溶液pH,可以向CH3COONa溶液中加适量的水,或增大NaClO2溶液pH,可以向NaClO2溶液中加适量NaOH固体,则bd正确.
故答案为:>;bd.
点评 本题考查物质的制备、对信息的利用、对装置的理解等,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大.

| A. | 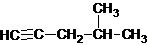 2-甲基-4-戊炔 2-甲基-4-戊炔 | |
| B. | CH2=C(C2H5)22-乙基-1-丁烯 | |
| C. | CH3CH(CH3)CH2CH(C2H5)CH3 2-甲基-4-乙基戊烷 | |
| D. | 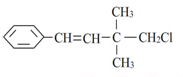 1,3,5-三硝基甲苯 1,3,5-三硝基甲苯 |
| A. | 温度升高,c(H2PO4-)增大 | |
| B. | 加水稀释后,m(H+)与m(OH-)的乘积减少 | |
| C. | c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-) | |
| D. | c(Na+)=c(H2PO4-)+c(HPO42-)+C(H3PO4) |
| A. | 0.1mol•L-1的Na2S溶液:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) | |
| B. | 常温下,pH=2的盐酸和pH=12的氨水等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1的NH4NO3溶液:c(NH4+)=c(NO3-) | |
| D. | 常温下,pH=3的H2SO3溶液:c(H+)=c(HSO3-)=1×10-5mol•L-1 |
反应历程为①O3═02+O(慢);②O3+O═2O2(快).下列说法正确的是:( )
| A. | 臭氧比氧气稳定 | B. | 臭氧分解的反应速率由步骤①决定 | ||
| C. | 反应的活化能等于285kJ•mol-1 | D. | 氧原子是该反应的催化剂 |