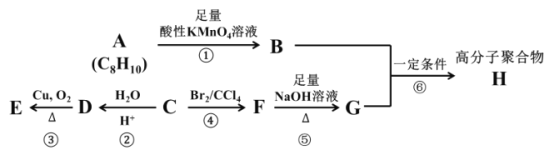
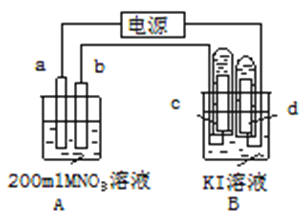
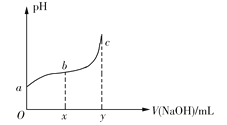
题目内容
【题目】下列有关实验现象和解释或结论都正确的是()
选项 | 实验操作 | 现象 | 解释或结论 |
A | 把SO2通入紫色石蕊试液中 | 紫色先变红后褪色 | SO2具有漂白性 |
B | 向AgCl沉淀中清加KI溶液 | 白色沉淀变为黄色 | 溶度积:AgI比AgCl更小 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 |
D | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
A. AB. BC. CD. D
【答案】B
【解析】
A.把SO2通入紫色石蕊试液中,发生反应:SO2+H2O=H2SO3,亚硫酸是二元酸,电离产生H+,使溶液显酸性,可以使紫色石蕊试液变为红色,A错误;
B.AgCl在溶液中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),当向溶液中加入KI溶液时,由于溶液中c(Ag+)·c(I-)>Ksp(AgI),会发生反应:Ag++I-=AgI↓,产生黄色沉淀,AgCl沉淀不断溶解,沉淀逐渐由白色转化为黄色,B正确;
Ag+(aq)+Cl-(aq),当向溶液中加入KI溶液时,由于溶液中c(Ag+)·c(I-)>Ksp(AgI),会发生反应:Ag++I-=AgI↓,产生黄色沉淀,AgCl沉淀不断溶解,沉淀逐渐由白色转化为黄色,B正确;
C. NO2气体存在化学平衡:2NO2![]() N2O4,将充满NO2的密闭玻璃球浸泡在热水中,气体颜色加浅,是由于升高温度,平衡向吸热的正反应方向移动,所以△H>0,C错误;
N2O4,将充满NO2的密闭玻璃球浸泡在热水中,气体颜色加浅,是由于升高温度,平衡向吸热的正反应方向移动,所以△H>0,C错误;
D.浓硫酸电离产生H+,使试纸变为红色,但同时浓硫酸具有脱水性,会使试纸中的H、O两种元素以水的组成脱去,试纸变为黑色C单质,所以把浓硫酸滴到pH试纸上,试纸先红色,最后变为黑色,D错误;
故合理选项是B。

 优生乐园系列答案
优生乐园系列答案【题目】用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 24.60 |
回答下列问题:
(1)如图中甲为___________滴定管,乙为_________ 滴定管(填“酸式”或“碱式 ”)
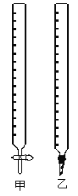
(2)实验中,需要润洗的仪器是:________________________
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是________________________________________
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果____________(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果___________。
(5) 未知浓度的NaOH溶液的物质的量浓度为_____________mol/l。