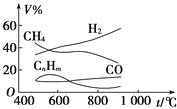
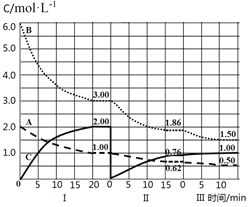
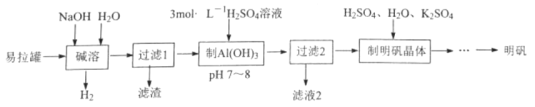
题目内容
【题目】如图所示装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答
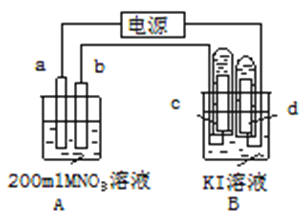
(1)a连接电源的__________极。b极的电极反应式为______________________________。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:_______________,电解进行一段时间后,罩在C极上的试管中也收集到了气体。此时C极上的电极反应式为________________________________
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了__________mol气体,若在b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为___________。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL。取该溶液逐滴加入到25.0mL0.1mol/L HCl溶液中,当加入25.00mL这种溶液时刚好沉淀完全。试计算电解前A烧杯中MNO3溶液的物质的量浓度为__________mol/L。
【答案】正 M++e-==M C电极周围先变蓝色 4OH--4e-=O2↑+2H2O 0.001mol 108g/mol 0.12mol/L
【解析】
根据电解原理,金属M沉积于b极,说明b是阴极,则a是阳极,c是阳极,d是阴极;
(1)根据a是阳极,A溶液中的阳离子M+得电子被还原;
(2)在B烧杯中,c是阳极,溶液中的阴离子放电,即2I--2e-=I2;根据放电顺序先放电的I-,接着是OH-放电;
(3)根据串联电路中以及电解池中阴、阳两极得失电子数目相等求出气体的物质的量和金属的物质的量,最后根据M=![]() 求出金属的摩尔质量;
求出金属的摩尔质量;
(4)先根据(3)求出已放电的M+的物质的量,然后根据剩余的溶液与HCl反应求出剩余的M+,两者相加得原溶液中的M+的物质的量,最后带入公式C=![]() ,求出电解前A烧杯中MNO3溶液的物质的量浓度。
,求出电解前A烧杯中MNO3溶液的物质的量浓度。
由电解原理可得:金属M沉积于b极,说明b是阴极,则a是阳极,c是阳极,d是阴极;
(1)由分析知a是阳极,b为阴极,电极反应式为M++e-==M;
(2)在B烧杯中,c是阳极,溶液中的阴离子放电,即2I--2e-=I2,I2遇到淀粉能使淀粉变蓝,I-放电完毕后;接着是OH-放电:4OH--4e=2H2O+O2↑,c极上的试管中收集到的气体为氧气;
(3)d极是溶液中氢离子放电:
2H+ + 2e-= H2↑
0.004mol ![]()
a极上氢氧根离子放电: 4OH--4e=2H2O+O2↑
0.004mol0.001mol
即氧气的物质的量为0.001mol
b极上M+离子放电: M+ + e- = M
0.004mol 0.004mol
则金属的摩尔质量M=![]() =
=![]() =108g/mol;
=108g/mol;
(4)设稀释后溶液的浓度为X,根据反应:Cl- + M+ = MCl↓
0.100 mol/L×0.025L X×0.025L
解得X=0.1molL-1,所以200mL电解停止后加蒸馏水稀释的溶液中,M+的物质的量为0.1molL-1×0.2L=0.02mol,则电解前A烧杯中MNO3溶液的M+物质的量=0.004mol+0.02mol=0.024mol,所以MNO3溶液的物质的量浓度=![]() mol/L=0.12mol/L。
mol/L=0.12mol/L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】温度T℃时,在3个1L的恒容密闭容器中发生:C0(g)+H20(g)= C02(g) + H2(g) △H =-41kJmol-1,其起始时投料的方式、各物质的量及其达平衡过程体系热量的变化入下表所示:
容器编号 | 起始各物质物质的量/mol | 达平衡过程体系热量的变化(均为正值) | |||
C0 | H20(g) | C02 | H2 | ||
① | 1 | 4 | 0 | 0 | 32.8kJ |
② | 8 | 2 | 0 | 0 | Q1 |
③ | 0 | 0 | 1 | 4 | Q2 |
下列说法中正确的是
A. 若经过10s容器①中反应达到平衡,则v(CO)=0.08molL-1s-1
B. 容器②和容器③中热量变化:Q2=Q1=32.8kJ
C. 若加入催化剂,改变了该反应的途径,反应的△H也随之改变
D. 保持相同条件,向平衡后的容器①中再加入0.2molCO(g)和0.8molCO2(g) ,则平衡不发生改变
【题目】下列有关实验现象和解释或结论都正确的是()
选项 | 实验操作 | 现象 | 解释或结论 |
A | 把SO2通入紫色石蕊试液中 | 紫色先变红后褪色 | SO2具有漂白性 |
B | 向AgCl沉淀中清加KI溶液 | 白色沉淀变为黄色 | 溶度积:AgI比AgCl更小 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 |
D | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
A. AB. BC. CD. D