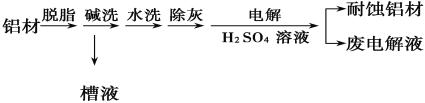
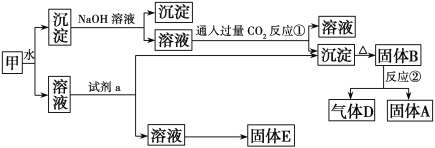
题目内容
【题目】反应2SO3(g)![]() 2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
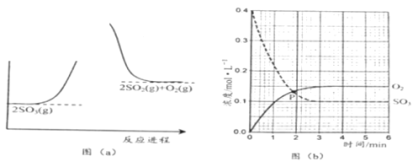
A.由图(a) 知,正反应为放热反应
B.图(b)中,SO3分解的平均速率0~1min比1~2min慢
C.图(b)中,P点时反应达到平衡状态
D.由图(b)知,SO2的平衡浓度为0.3mol·L-1
【答案】D
【解析】
A.由图(a) 知,反应物SO3(g)能量低,生成物2SO2(g) + O2(g)能量高,根据能量守恒定律,该反应的正反应为吸热反应,故A错误;
B.由图(b)知,浓度越大,反应速率越快,0~1min时SO3(g)减小了0.2mol/L,1~2min时SO3(g)减小了0.07mol/L,则0~1min平均速率比1~2min快,故B错误;
C.由图(b)知,P点时SO3(g)和O2(g)的浓度相等,隨着时间进行,SO3(g)继续减少,O2(g)继续增多,到3min时,二者浓度不再改变,达平衡状态,因而P点不是平衡状态,故C点错误;
D.由图(b)知,3min时达平衡状态,c(SO3)=0.10mol/L,消耗了0.3mol/L的SO3(g),根据2SO3(g)![]() 2SO2(g) + O2(g),可知达平衡时c(SO2)=0.3mol/L,故D正确;
2SO2(g) + O2(g),可知达平衡时c(SO2)=0.3mol/L,故D正确;
答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】下列有关实验现象和解释或结论都正确的是()
选项 | 实验操作 | 现象 | 解释或结论 |
A | 把SO2通入紫色石蕊试液中 | 紫色先变红后褪色 | SO2具有漂白性 |
B | 向AgCl沉淀中清加KI溶液 | 白色沉淀变为黄色 | 溶度积:AgI比AgCl更小 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 |
D | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
A. AB. BC. CD. D