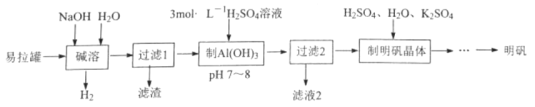
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ25Γφ ±Θ§œρ50mLΚ§”–0.1molCl2ΒΡ¬»Υ°÷–ΒΈΦ”2molΓΛL1ΒΡNaOH»ή“ΚΘ§ΒΟΒΫ»ή“ΚpHΥφΦ”»κNaOH»ή“ΚΧεΜΐΒΡ±δΜ·»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
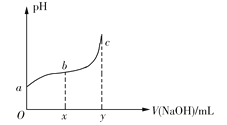
A.»τaΒψpH=4Θ§«“c(Cl)=mc(HClO)Θ§‘ρHClOΒΡΒγάκΤΫΚβ≥Θ ΐΈΣ![]()
B.»τx=100Θ§bΒψΕ‘”Π»ή“Κ÷–Θ§c(OH)>c(H+)Θ§Ω…”ΟpH ‘÷Ϋ≤βΕ®ΤδpH
C.»τy=200Θ§cΒψΕ‘”Π»ή“Κ÷–Θ§c(OH)c(H+)=2c(Cl)+c(HClO)
D.bΓζcΕΈΘ§ΥφNaOH»ή“ΚΒΡΒΈ»κΘ§![]() ÷πΫΞ‘ω¥σ
÷πΫΞ‘ω¥σ
ΓΨ¥πΑΗΓΩC
ΓΨΫβΈωΓΩ
AΘ°pH=4Θ§‘ρ»ή“Κ÷–c(H+)=104molΓΛL1Θ§ΗυΨίΖΫ≥Χ ΫΘΚCl2+H2O![]() HCl+HClOΘ§HClO
HCl+HClOΘ§HClO![]() H++ClOΘ§»ή“Κ÷–c(Cl)=c(ClO)+c(HClO)=mc(HClO)Θ§c(HClO)=
H++ClOΘ§»ή“Κ÷–c(Cl)=c(ClO)+c(HClO)=mc(HClO)Θ§c(HClO)=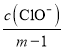 Θ§Ka(HClO)=
Θ§Ka(HClO)=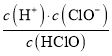 =
=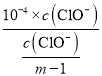 =104(m1)Θ§Aœν¥μΈσΘΜ
=104(m1)Θ§Aœν¥μΈσΘΜ
BΘ°…ζ≥…ΒΡNaClO÷–ΒΡClOΥ°ΫβΘ§ΒΟΒΫΒΡHClOΨΏ”–Τ·ΑΉ–‘Θ§≤ΜΡή”ΟpH ‘÷Ϋ≤βΕ®Ζ¥”ΠΚσ»ή“ΚΒΡpHΘ§Bœν¥μΈσΘΜ
CΘ°cΒψ ±Θ§¬»Υ°»Ϊ≤Ω”κNaOH»ή“ΚΖ¥”Π…ζ≥…NaClOΓΔNaClΘ§«“n(Cl)=n(ClO)+n(HClO)Θ§ΗυΨίΒγΚ… ΊΚψ”–ΘΚn(Na+)+n(H+)=n(OH)+n(Cl)+n(ClO)Θ§ΗυΨίΈοΝœ ΊΚψ”–ΘΚn(ClO)+n(Cl)+n(HClO)=0.2molΘ§n(Na+)=0.4molΘ§‘ρ”–ΘΚ2n(ClO)+2n(Cl)+2n(HClO)+n(H+)=n(OH)+n(Cl)+n(ClO)Θ§Φ¥”–ΘΚc(OH)c(H+)=2c(Cl)+c(HClO)Θ§Cœν’ΐ»ΖΘΜ
DΘ°bΓζcΕΈΘ§ΥφΉ≈NaOH»ή“ΚΦ”»κΘ§c(HClO)≈®Ε»÷πΫΞΦθ–ΓΘ§c(ClO)÷πΫΞ‘ω¥σΘ§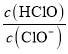 ÷πΫΞΦθ–ΓΘ§Dœν¥μΈσΓΘ
÷πΫΞΦθ–ΓΘ§Dœν¥μΈσΓΘ
¥πΑΗ―ΓCΓΘ

ΓΨΧβΡΩΓΩΈ¬Ε»TΓφ ±Θ§‘Ύ3Ηω1LΒΡΚψ»ίΟή±’»ίΤς÷–ΖΔ…ζΘΚC0(g)+H20(g)= C02(g) + H2(g) ΓςH =-41kJmol-1,ΤδΤπ Φ ±ΆΕΝœΒΡΖΫ ΫΓΔΗςΈο÷ ΒΡΝΩΦΑΤδ¥οΤΫΚβΙΐ≥ΧΧεœΒ»»ΝΩΒΡ±δΜ·»κœ¬±μΥυ ΨΘΚ
»ίΤς±ύΚ≈ | Τπ ΦΗςΈο÷ Έο÷ ΒΡΝΩ/mol | ¥οΤΫΚβΙΐ≥ΧΧεœΒ»»ΝΩΒΡ±δΜ·Θ®ΨυΈΣ’ΐ÷ΒΘ© | |||
C0 | H20(g) | C02 | H2 | ||
ΔΌ | 1 | 4 | 0 | 0 | 32.8kJ |
ΔΎ | 8 | 2 | 0 | 0 | Q1 |
Δέ | 0 | 0 | 1 | 4 | Q2 |
œ¬Ν–ΥΒΖ®÷–’ΐ»ΖΒΡ «
A. »τΨ≠Ιΐ10s»ίΤςΔΌ÷–Ζ¥”Π¥οΒΫΤΫΚβΘ§‘ρv(CO)=0.08molL-1s-1
B. »ίΤςΔΎΚΆ»ίΤςΔέ÷–»»ΝΩ±δΜ·ΘΚQ2=Q1=32.8kJ
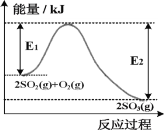
C. »τΦ”»κ¥ΏΜ·ΦΝΘ§ΗΡ±δΝΥΗΟΖ¥”ΠΒΡΆΨΨΕΘ§Ζ¥”ΠΒΡΓςH“≤Υφ÷°ΗΡ±δ
D. ±Θ≥÷œύΆ§ΧθΦΰΘ§œρΤΫΚβΚσΒΡ»ίΤςΔΌ÷–‘ΌΦ”»κ0.2molCO(g)ΚΆ0.8molCO2(g) Θ§‘ρΤΫΚβ≤ΜΖΔ…ζΗΡ±δ
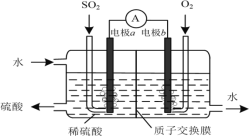
ΓΨΧβΡΩΓΩœ¬Ν–”–ΙΊ Β―ιœ÷œσΚΆΫβ ΆΜρΫα¬έΕΦ’ΐ»ΖΒΡ «()
―Γœν | Β―ι≤ΌΉς | œ÷œσ | Ϋβ ΆΜρΫα¬έ |
A | Α―SO2Ά®»κΉœ…Ϊ ·»ο ‘“Κ÷– | Ήœ…Ϊœ»±δΚλΚσΆ …Ϊ | SO2ΨΏ”–Τ·ΑΉ–‘ |
B | œρAgCl≥ΝΒμ÷–«εΦ”KI»ή“Κ | ΑΉ…Ϊ≥ΝΒμ±δΈΣΜΤ…Ϊ | »ήΕ»ΜΐΘΚAgI±»AgClΗϋ–Γ |
C | ΫΪ≥δ¬ζNO2ΒΡΟή±’≤ΘΝß«ρΫΰ≈ί‘Ύ»»Υ°÷– | ΚλΉΊ…Ϊ±δ«≥ | Ζ¥”Π2NO2 |
D | Α―≈®ΝρΥαΒΈΒΫpH ‘÷Ϋ…œ | ‘÷Ϋ±δΚλ | ≈®ΝρΥαΨΏ”–Υα–‘ |
A. AB. BC. CD. D