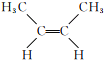
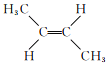
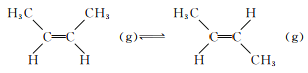题目内容
【题目】25 ℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,则下列说法正确的是( )
A.该溶液的pH一定是9B.该溶液的pH可能为5
C.该溶液的pH可能是7D.不会有这样的溶液
【答案】B
【解析】
25℃时,纯水中水电离产生的c(H+)c(OH-)=1×10-14,该溶液中由水电离产生的c(H+)c(OH-)=1×10-18<1×10-14,说明该溶液中的溶质抑制水电离,则溶液可能是酸或碱溶液:
①若为酸液,因为由水电离的氢离子等于由水电离的氢氧根离子,故由水电离的氢氧根离子浓度=![]() =1×109molL1,故溶液中的氢离子浓度=
=1×109molL1,故溶液中的氢离子浓度=![]() =1×105,故溶液pH=5;
=1×105,故溶液pH=5;
②若为碱液,溶液中的氢离子全部由水电离,故溶液中的氢离子浓度=![]() =1×109molL1,故溶液pH=9;
=1×109molL1,故溶液pH=9;
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
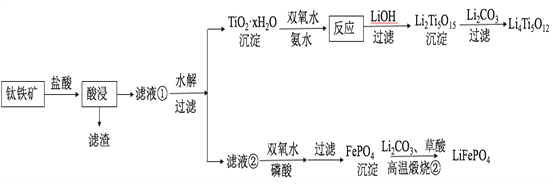
回答下列问题:
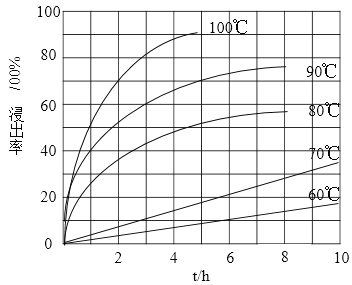
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
【题目】水是生命的源泉、工业的血液、城市的血脉。要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在T ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,由水电离出的c(OH-)=________ mol·L-1。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为____________________,由水电离出的c(OH-)=________mol·L-1。
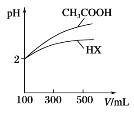
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
在25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
【题目】一直反应:2NO2(红棕色)![]() N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
n(NO2) | 0.40 | a | 0.26 | c | d | e |
n(N2O4) | 0.00 | 0.05 | b | 0.08 | 0.08 | 0.08 |
(1)a、b、c、d、e中属于平衡状态的是_____________,100s后降低反应混合物的温度,混合气体的颜色_________(填“变浅”、“变深”或“不变”)。
(2)20~40s内,v(NO2)=__________mol/(L·s),100℃时该反应的平衡常数K =_____________。
(3)将一定量的NO2充入密闭注射器中,图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是______________

A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若密闭注射器为绝热容器,则T(b)>T(c)
D.d点时v(正)>v(逆)
(4)能说明反应2NO2(红棕色)![]() N2O4(无色)达平衡的是_________
N2O4(无色)达平衡的是_________
A. 体系的颜色不变
B. 恒容条件下,气体的额密度不变
C. 2v正(NO2)=v逆(N2O4)/p>
D. 混合气体的平均摩尔质量不变
(5)100℃时,容器中物质的量的变化曲线如图,请画出80℃时物质的量的变化曲线并进行适当标注。______