题目内容
【题目】研究CO和CO2的应用对构建低碳、环保的生态文明型社会具有重要的意义。以CO和H2为原料可以制取甲醇。已知部分反应的热化学方程式如下:
反应Ⅰ CO(g)+2H2(g)![]() CH3OH(g) ΔH=-99 kJ·mol-1
CH3OH(g) ΔH=-99 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(l) ΔH=-3 kJ·mol-1
CO(g)+H2O(l) ΔH=-3 kJ·mol-1
反应Ⅲ H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
(1)反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=____kJ·mol-1。
CH3OH(g)+H2O(g)的ΔH=____kJ·mol-1。
(2)向T1℃的恒容密闭容器中充入一定量的CO和H2,发生反应Ⅰ,保持温度不变,测得CH3OH的物质的量随时间的变化关系如图所示。
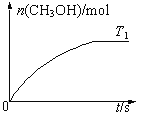
①下列条件可以判定反应到达平衡状态的是____(填字母)。
A.2v正(H2)=v逆(CH3OH)
B.容器内气体的密度不变
C.容器内压强不变
D.反应不再释放热量
②在图中作出当其他条件不变,温度改为T2℃(T1<T2)时CH3OH的物质的量随时间的变化关系图。_____
(3)体积可变的密闭容器中,起始n(H2)/n(CO)=2.60时,反应Ⅰ体系中CO的平衡转化率(α)与温度和压强的关系如图所示。
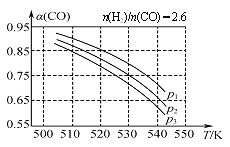
①α(CO)随温度升高而减小的原因是____。
②图中压强p1、p2、p3中最大的是____。
③若起始CO、H2、CH3OH的物质的量分别为0 mol、1.2 mol、2 mol,保持温度为530K、压强为p2,反应达到平衡时,CH3OH的转化率是____。
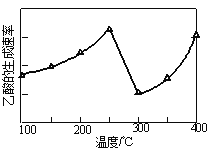
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是____。
【答案】-58 CD 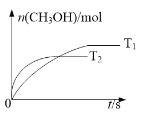 正反应为放热反应,升高温度,平衡向逆反应方向移动,CO的转化率减小 p1 25% 催化剂失去活性(或催化剂活性降低)
正反应为放热反应,升高温度,平衡向逆反应方向移动,CO的转化率减小 p1 25% 催化剂失去活性(或催化剂活性降低)
【解析】
(1)根据盖斯定律分析计算;
(2)①可逆反应达到平衡时,同种物质的正逆反应速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随着反应进行发生变化,该物理量由变化到不再变化说明达到平衡;
②在图中做出当其他条件不变,温度改为T2℃(T1<T2)时,升温平衡逆向进行,甲醇的物质的量减少,达到平衡的时间缩短,据此画出随时间的变化关系图;
(3)①α(CO)随温度升高而减小的原因是反应为放热反应,升温平衡逆向进行;
②反应Ⅰ是气体体积减小的放热反应,温度一定,压强越大,平衡正向进行;
③若起始一氧化碳和氢气和甲醇的物质的量分别为0 mol、1.2 mol、2 mol,相当于加入2mol一氧化碳和5.2mol氢气,起始n(H2)/n(CO)=2.60,根据图像可知,压强为p2时一氧化碳的转化率为75%,平衡时剩余的一氧化碳为2mol×(1-75%)=0.5mol,两个平衡互为等效平衡,达到平衡时各组分的浓度不变,则原平衡达到平衡状态时一氧化碳的物质的量为0.5mol,根据反应可知,转化的甲醇的物质的量为0.5mol,据此计算甲醇的转化率。
(4)该反应中使用了催化剂,结合催化剂的催化活性受温度影响分析。
(1)根据盖斯定律分析计算,反应Ⅰ CO(g)+2H2(g)![]() CH3OH(g) ΔH=-99 kJ·mol-1,反应Ⅱ CO2(g)+H2(g)
CH3OH(g) ΔH=-99 kJ·mol-1,反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(l) ΔH=-3 kJ·mol-1,反应Ⅲ H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,Ⅰ-Ⅱ-Ⅲ得热化学方程式为:CO2(g)+3H2(g)
CO(g)+H2O(l) ΔH=-3 kJ·mol-1,反应Ⅲ H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,Ⅰ-Ⅱ-Ⅲ得热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=-99+3+44=-58kJ·mol-1;
CH3OH(g)+H2O(g)的ΔH=-99+3+44=-58kJ·mol-1;
(2)①A.2v正(H2)=v逆(CH3OH)不能说明甲醇的正逆反应速率相同,故错误;B.反应前后质量和体积不变,容器内气体的密度始终不变,不能说明反应到平衡,故错误;C.反应前后气体物质的量变化,说明容器内压强不变能说明反应到平衡。故正确;D.反应不再释放热量说明正逆反应速率相等,反应到平衡,故正确。故选CD。
②在图中做出当其他条件不变,温度改为T2℃(T1<T2)时,升温平衡逆向进行,甲醇的物质的量减少,达到平衡的时间缩短,据此画出随时间的变化关系图: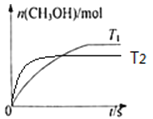 ;
;
(3)①α(CO)随温度升高而减小的原因是反应为放热反应,升温平衡逆向进行;
②反应Ⅰ是气体体积减小的放热反应,温度一定,压强越大,平衡正向进行,一氧化碳的转化率增大,所以压强大小关系为p1>p2>p3,压强最大的是p1;
③若起始一氧化碳和氢气和甲醇的物质的量分别为0 mol、1.2 mol、2 mol,相当于加入2mol一氧化碳和5.2mol氢气,起始n(H2)/n(CO)=2.60,根据图像可知,压强为p2时一氧化碳的转化率为75%,平衡时剩余的一氧化碳为2mol×(1-75%)=0.5mol,两个平衡互为等效平衡,达到平衡时各组分的浓度不变,则原平衡达到平衡状态时一氧化碳的物质的量为0.5mol,根据反应CO(g)+2H2(g)![]() CH3OH(g)可知,转化的甲醇的物质的量为0.5mol,甲醇的转化率为
CH3OH(g)可知,转化的甲醇的物质的量为0.5mol,甲醇的转化率为![]() 。
。
(4)该反应中使用了催化剂,温度超过250℃,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低。

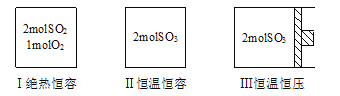
【题目】一定温度下,在三个体积相同的恒容密闭容器中发生反应:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
C(s) | H2O(g) | CO(g) | H2(g) | CO(g) | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0 | 0.4 |
Ⅱ | 500 | 0 | 0 | 2.0 | 2.0 | |
Ⅲ | 400 | 1.0 | 1.0 | 0 | 0 | 0.3 |
下列说法正确的是
A.该反应的正反应为吸热反应
B.达到平衡时,容器内的压强:2PⅠ<PⅡ
C.达到平衡时,反应物的转化率αⅠ(H2O)+αⅡ(CO)<1
D.若起始时向容器Ⅰ中加入2.7 mol C(s)、0.4mol H2O(g)、0.6mol CO(g)和0.6mol H2(g),则反应将向逆反应方向进行
【题目】TiO2广泛应用于涂料、塑料、造纸、印刷油墨等领域。TiOSO4溶液加水稀释可析出aTiO2·bH2O沉淀。
(1)写出TiOSO4溶液加水稀释时所发生反应的化学方程式:____。
(2)实验室测定aTiO2·bH2O组成的方法如下:
步骤一:取样品4.900 g,在酸性条件下充分溶解,加入适量铝将溶解生成的TiO2+还原为Ti3+,将溶液转移到容量瓶中,并定容至250 mL。
步骤二:取25.00 mL定容后的溶液于锥形瓶中,加入KSCN溶液作指示剂,用0.2000mol·L-1的NH4Fe(SO4)2 标准溶液滴定,将实验数据记录在下表中。重复滴定2次。滴定过程发生的物质转化为:Ti3+![]() TiO2+
TiO2+
滴定序号 | 待测液体积/mL | NH4Fe(SO4)2标准溶液 | |
滴定管起点读数/mL | 滴定管终点读数/mL | ||
1 | 25.00 | 0.04 | 25.04 |
2 | 25.00 | 0.07 | 25.05 |
3 | 25.00 | 0.13 | 25.15 |
①使用滴定管过程中所涉及下列操作的先后顺序是____(填字母)。
a.排除滴定管尖嘴处的气泡 b.检查滴定管是否漏液 c.用待装液润洗滴定管
②滴定终点的实验现象是____。
③通过计算确定该样品的组成,写出计算过程____。