题目内容
【题目】T ℃时,在0.5 L的密闭容器中,气体A与气体B反应生成气体C,反应过程中A、B、C的浓度变化如图所示。则下列结论正确的是

A. 10 s时反应生成了0.2 mol C
B. 该反应进行到10 s时,消耗了0.2 molA
C. 该反应的化学方程式为3A+B![]() 2C
2C
D. 10 s内用B表示的反应速率为0.01 mol·L-1·s-1
【答案】A
【解析】A、10 s时反应生成了C的浓度是0.4mol/L,则C的物质的量是0.4mol/L×0.5L=0.2 mol,A正确;B、该反应进行到10 s时,消耗A的物质的量是(0.5-0.3)mol/L×0.5L=0.1 mol,B错误;C、该反应进行到10 s时,消耗B的物质的量是(0.7-0.1)mol/L×0.5L=0.3 mol,根据变化量之比是化学计量数之比可知该反应的化学方程式为A+3B![]() 2C,C错误;D、根据以上分析可知10 s内用B表示的反应速率为(0.7-0.1)mol/L÷10s=0.06 mol·L-1·s-1,D错误,答案选A。
2C,C错误;D、根据以上分析可知10 s内用B表示的反应速率为(0.7-0.1)mol/L÷10s=0.06 mol·L-1·s-1,D错误,答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】利用右图装置测定中和热的实验步骤如下: 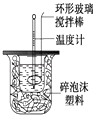
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,并测出其温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式(中和热数值为57.3kJ/mol): .
(2)倒入NaOH溶液的正确操作是 .
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)实验数据如表:
①请填写下表中的空白:
温度 | 起始温 | 终止温度t2/℃ | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=( 保留一位小数).
【题目】下列依据实验操作及现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3 > C12 |
C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. A B. B C. C D. D
【题目】下列除去杂质的方法正确的是( )
物质 | 杂质 | 试剂 | 主要操作 | |
A | NaHCO3固体 | Na2CO3固体 | / | 加热 |
B | SiO2 | Al2O3 | 氢氧化钠溶液 | 过滤 |
C | Cl2 | HCl | 饱和食盐水 | 洗气 |
D | CO2 | HCl | 饱和碳酸钠溶液 | 洗气 |
A. A B. B C. C D. D
【题目】将0.2mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
已知:离子方程式:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀).
A. ①和② B. ②和④ C. ③和④ D. ①