题目内容
15.下列有关化学用语表示正确的是( )| A. | H2F+的电子式: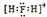 | |
| B. | 铝原子的结构示意图: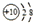 | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{45}$Br | |
| D. | K2CO3水解的离子方程式:CO32-+2H2O?H2CO3+2OH- |
分析 A.H2F+为阳离子,所有原子都需要标出最外层电子;
B.铝原子的核电荷数为13,不是10,最外层为3个电子;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.碳酸根离子的水解分步进行,主要以第一步为主.
解答 解:A.H2F+为阳离子,H、F原子需要标出最外层电子,其电子式为: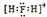 ,故A正确;
,故A正确;
B.铝原子的核电荷数=核外电子总数=13,其原子结构示意图为: ,故B错误;
,故B错误;
C.质子数为35、中子数为45的溴原子质量数为80,该核素正确的表示方法为:3580Br,故C错误;
D.碳酸钾水解实质为碳酸根离子水解,碳酸根离子的水解需要分步进行,主要以第一步为主,其正确的离子方程式:CO32-+H2O?HCO3-+OH-,故D错误;
故选A.
点评 本题考查了常见化学用语的书写判断,题目难度中等,涉及原子结构示意图、电子式、元素符号、离子方程式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生规范答题的能力.

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
16.下列四幅图中,与胶体性质有关的是( )


| A. | ①④ | B. | ②③ | C. | ①②③ | D. | 全部 |
10.软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4•H2O的流程如下:

已知:①部分金属阳离子完全沉淀时的pH如下表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低.
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为MnO2+SO2=SO42-+Mn2+;
(2)调pH至5-6的目的是沉淀Fe3+和Al3+,调pH至5-6所加的试剂可选择bc(填以下试剂的序号字母);
a.NaOH b.MgO c.CaO d.氨水
(3)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式MnF2+Mg2+=Mn2++MgF2,该反应的平衡常数数值为7.2×107.
(已知:MnF2的KSP=5.3×10-3; CaF2的KSP=1.5×10-10;MgF2的KSP=7.4×10-11)
(4)取少量MnSO4•H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是Mn2++H2O=Mn(OH)2+2H+(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为c(SO42-)>c(Mn2+)>c(H+)>c(OH-).

已知:①部分金属阳离子完全沉淀时的pH如下表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH值 | 3.2 | 5.2 | 10.4 | 12.4 |
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为MnO2+SO2=SO42-+Mn2+;
(2)调pH至5-6的目的是沉淀Fe3+和Al3+,调pH至5-6所加的试剂可选择bc(填以下试剂的序号字母);
a.NaOH b.MgO c.CaO d.氨水
(3)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式MnF2+Mg2+=Mn2++MgF2,该反应的平衡常数数值为7.2×107.
(已知:MnF2的KSP=5.3×10-3; CaF2的KSP=1.5×10-10;MgF2的KSP=7.4×10-11)
(4)取少量MnSO4•H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是Mn2++H2O=Mn(OH)2+2H+(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为c(SO42-)>c(Mn2+)>c(H+)>c(OH-).
20.由实验现象推出的结论正确的是( )
| 选项 | 实验方案 | 现象 | 结论 |
| A | 将水垢置于盛食醋的试管中 | 有气泡产生 | 醋酸的酸性比碳酸强 |
| B | 用湿润的蓝色试纸检验某气体 | 试纸变红 | 气体是酸性氧化物 |
| C | 向饱和Na2CO3溶液中通入CO2 | 有晶体析出 | NaHCO3不溶于水 |
| D | 向酚酞溶液中加少量Na2O2 | 溶液变红 | Na2O2是碱性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
7.从绿色化学和经济效益角度考虑,制取Cu(NO3)2最适宜采用的方法是( )
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3(稀)→Cu(NO3)2 | ||
| C. | Cu$\stackrel{空气}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2 | D. | Cu+AgNO3→Cu(NO3)2 |
4.下列说法正确的是( )
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性均依次减弱 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,1molNH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
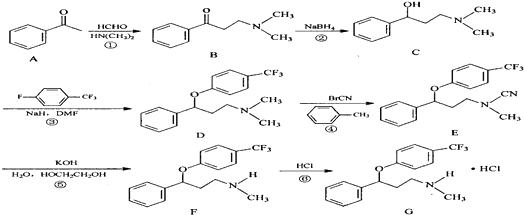

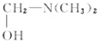 .
.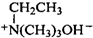 $\stackrel{△}{→}$CH2=CH2;请写出以
$\stackrel{△}{→}$CH2=CH2;请写出以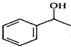 、HCHO、HN(CH3)2为有机原料,合成
、HCHO、HN(CH3)2为有机原料,合成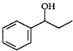 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.
 HCO18OCH3+H2O.
HCO18OCH3+H2O.