题目内容
12.下列两组命题中,N组命题正确,且能用M组命题加以解释的是( )| M组 | N组 | |
| A | H-I键键能大于H-Cl键键能 | HI比HCl稳定 |
| B | HI分子间作用力小于HCl分子间作用力 | HCl比HI稳定 |
| C | HI分子间作用力大于HCl分子间作用力 | HI的沸点比HCl高 |
| D | H-I键键能小于H-Cl键键能 | HI的沸点比HCl高 |
| A. | A | B. | B | C. | C | D. | D |
分析 分子的稳定性与键能大小有关,键能越大,分子越稳定,而分子间作用力影响分子的沸点高低,以此解答该题.
解答 解:A.H-I的键能比H-Cl小,HCl较稳定,故A错误;
B.分子的稳定性与键能大小有关,与分子间作用力无关,故B错误;
C.HI、HCl的沸点高低取决于分子间作用力,相对分子质量越大,分子间作用力越大,沸点越高,故C正确;
D.键能的大小与分子晶体的沸点高低无关,故D错误.
故选C.
点评 本题考查共价键、分子间作用力知识,为高频考点,侧重于基本概念的理解和应用的考查,注意把握微粒间的作用力与性质的关系,难度不大.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
12.下列由相关实验现象所推出的结论正确的是( )
| A. | 铁在常温下不溶于浓硝酸,说明铁与浓硝酸不反应 | |
| B. | 将氯气溶于水后溶液呈浅黄绿色,说明氯气与水没有完全反应 | |
| C. | 将某气体通入品红溶液中溶液褪色,说明该气体一定是二氧化硫 | |
| D. | 向溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- |
20.由实验现象推出的结论正确的是( )
| 选项 | 实验方案 | 现象 | 结论 |
| A | 将水垢置于盛食醋的试管中 | 有气泡产生 | 醋酸的酸性比碳酸强 |
| B | 用湿润的蓝色试纸检验某气体 | 试纸变红 | 气体是酸性氧化物 |
| C | 向饱和Na2CO3溶液中通入CO2 | 有晶体析出 | NaHCO3不溶于水 |
| D | 向酚酞溶液中加少量Na2O2 | 溶液变红 | Na2O2是碱性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
7.从绿色化学和经济效益角度考虑,制取Cu(NO3)2最适宜采用的方法是( )
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3(稀)→Cu(NO3)2 | ||
| C. | Cu$\stackrel{空气}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2 | D. | Cu+AgNO3→Cu(NO3)2 |
17.β-紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1.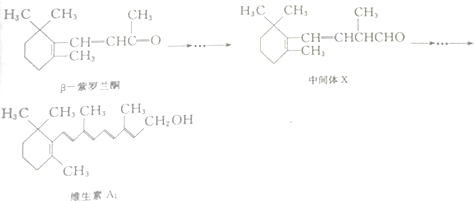
下列说法正确的是( )

下列说法正确的是( )
| A. | β-紫罗兰酮在核磁共振氢谱图中有7组峰 | |
| B. | β-紫罗兰酮与中间体X互为同分异构体 | |
| C. | 1mol中间体X最多能与2mol H2发生加成反应 | |
| D. | 维生素A1能发生取代反应、加成反应和氧化反应 |
4.下列说法正确的是( )
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性均依次减弱 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,1molNH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
 .
.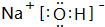 或
或 等,一种共价化合物的电子式为
等,一种共价化合物的电子式为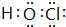 等.
等.