题目内容
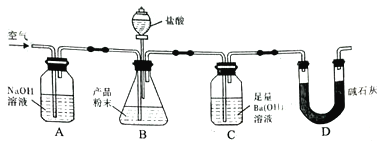
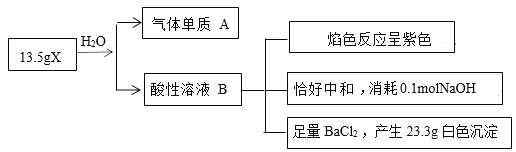
【题目】为探究无机盐X(仅含三种元素,摩尔质量为270g·mol-1)的组成和性质,某学习小组进行了如下实验,其中气体单质A能使带火星的木条复燃。
(1)X的组成元素为O和______(用元素符号表示)。
(2)写出X与水反应的化学反应方程式__________。
(3)X氧化能力极强,且对环境友好,可用于脱硫、脱硝。在碱性条件下,X氧化SO32-的离子方程式__________。
【答案】S和K 2K2S2O8+2H2O=4KHSO4+O2↑ S2O82-+SO32-+2OH-=3SO42-+H2O
【解析】
根据气体单质A能使带火星的木条复燃,说明A是O2,根据焰色反应呈紫色,判断含有K元素,根据n=![]() 计算X的物质的量及BaSO4的物质的量,根据H++
计算X的物质的量及BaSO4的物质的量,根据H++
OH-=H2O计算B溶液中H+的物质的量,利用元素守恒、结合元素化合价确定X中含有的元素及原子个数,确定化学式,利用氧化还原反应规律书写X与SO32-的反应的离子方程式。
(1)X与水反应产生的B溶液进行焰色反应,火焰呈紫色,说明B溶液中含有K+,B溶液显酸性,说明含有大量的H+;向该酸性溶液中加入BaCl2溶液,产生白色沉淀,沉淀是BaSO4,说明B溶液中含有SO42-离子,结合元素守恒,可判断X中含有的元素有K、S、O三种元素;
(2)13.5gX的物质的量n(X)=![]() =0.05mol,n(SO42-)=n(BaSO4)=
=0.05mol,n(SO42-)=n(BaSO4)=![]() =0.1mol,根据H++
=0.1mol,根据H++
OH-=H2O可知n(H+)=n(OH-)=0.1mol,则B中n(H+):n(SO42-)=0.1mol:0.1mol=1:1,该溶液中还含有K+,根据电荷守恒可知B为KHSO4,气体单质A能使带火星的木条复燃,说明A是O2,0.05molX与水反应产生0.5molSO42-,则X中含有2个S原子,结合氧化还原反应规律,结合其含有的元素,可知X 为K2S2O8,则X与H2O反应的化学方程式为2K2S2O8+2H2O=4KHSO4+O2↑;
(3)K2S2O8具有强的氧化性,在碱性条件下,X氧化SO32-为SO42-,S2O82-被还原产生SO42-,反应的离子方程式为:S2O82-+SO32-+2OH-=3SO42-+H2O。

【题目】在标准状况下进行甲、乙、丙三组实验:各取200mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/g | 2.55 | 3.85 | 4.59 |
生成气体体积/L | 2.80 | 3.36 | 3.36 |
试回答:
(1)盐酸的物质的量浓度为________。(保留三位有效数字)
(2)合金中镁铝的物质的量之比_______。