题目内容
【题目】向如图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.X和Y可能是
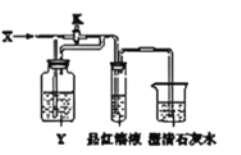
A | B | C | D | |
X | NO2 | SO2 | HCl | Cl2 |
Y | 饱和NaOH溶液 | 饱和碳酸氢钠溶液 | 亚硫酸钠溶液 | 亚硫酸钠溶液 |
A.AB.BC.CD.D
【答案】B
【解析】
根据SO2、NO2、Cl2、HCl、CO2的有关化学性质可知,能使品红褪色的气体可能为SO2、NO2和Cl2,二氧化碳和二氧化硫都能使澄清石灰水变浑浊.
若打开活塞K,品红溶液褪色,X气体只可能是SO2、NO2或Cl2;关闭活塞K,
A、若X是NO2,通入饱和NaOH溶液中发生反应:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2被吸收,与品红溶液、澄清石灰水不反应,故A不符合;
B、若X气体为SO2,通入饱和NaHCO3溶液后发生反应:SO2+2NaHCO3═Na2SO3+2CO2↑+H2O,SO2被吸收而放出CO2,所以品红溶液无变化,而澄清石灰水变浑浊,故B符合;
C、若打开活塞K,品红溶液褪色,X气体只可能是SO2、NO2或Cl2,故C不符;
D、若X是Cl2,Cl2通入Na2SO3溶液后发生反应:Cl2+Na2SO3+H2O=Na2SO4+2HCl,无气体放出,所以品红溶液无变化,而澄清石灰水不变浑浊,故D不符;
故选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目