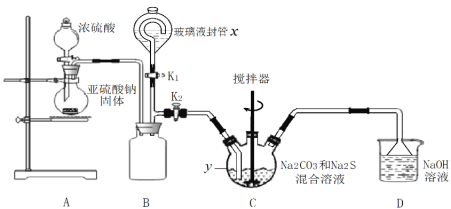
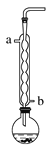
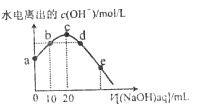
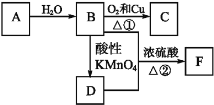
题目内容
【题目】下列各组分子中,都由极性键构成的极性分子的一组是
A. C3H6和CO2 B. CCl4和H2S C. H2O和NH3 D. H2O2和CS2
【答案】C
【解析】
A.C3H6可能是丙烯也可能是环丙烷,丙烯和环丙烷均是含有极性键的极性分子,而CO2中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子故A错误;
B.CCl4中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子;![]() 中含有极性键,空间结构为v形,正负电荷的中心不重合,属于极性分子,故B错误;
中含有极性键,空间结构为v形,正负电荷的中心不重合,属于极性分子,故B错误;
C. H2O中含有极性键,空间结构为V型,正负电荷的中心不重合,属于极性分子,NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子,故C正确;
D.H2O2中含有极性键和非极性键,正负电荷的中心不重合,属于极性分子,CS2含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子,故D错误;
本题答案为C。

练习册系列答案
相关题目
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 工业制硫酸中,在矿石处理阶段,将矿石粉碎再煅烧 | 增大反应物的接触面积,加快化学反应速率 |
B | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入MnO2,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
C | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
D | 一定条件下:H2(g)+I2(g) | c(I2)增大,I2物质的量增多 |
A. A B. B C. C D. D