题目内容
7.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: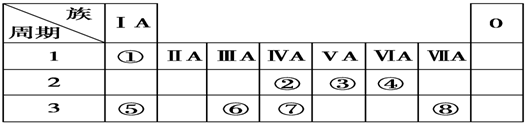
(1)④、⑥的原子半径由大到小的顺序是:(请用>、<表示)Al>O.
(2)③的最高价含氧酸为:HNO3.
(3)②的氢化物结构式是:
 .②的最高价氧化物的电子式是:
.②的最高价氧化物的电子式是:
(4)⑤、⑥两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是:Al(OH)3+OH-═AlO2-+2H2O.
(5)以上八种元素中金属性最强的为Na,显两性的元素为Al.
分析 由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)电子层越多半径越大,电子层相同时核电荷数越大半径越小;
(2)③是N,最高价含氧酸为硝酸;
(3)②是C,其氢化物为甲烷,其最高价氧化物为二氧化碳;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠和水;
(5)同周期从左到右金属性减弱,同主族从上到下金属性增强.
解答 解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)电子层越多半径越大,电子层相同时核电荷数越大半径越小,所以Al>O,故答案为:Al>O;
(2)③是N,最高价含氧酸为硝酸,其化学式为HNO3,故答案为:HNO3;
(3)②是C,其氢化物为甲烷,其结构式为 ,其最高价氧化物为二氧化碳,其电子式为
,其最高价氧化物为二氧化碳,其电子式为 ;
;
故答案为: ;
; ;
;
(4)⑤、⑥两种元素的最高价氧化物对应的水化物分别为NaOH、氢氧化铝,二者反应生成偏铝酸钠与水,反应离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(5)同周期从左到右金属性减弱,同主族从上到下金属性增强,则八种元素中金属性最强的为Na,显两性的元素为Al,故答案为:Na;Al.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物性质为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
相关题目
17.用盐酸标准液来滴定NaOH待测液,下列操作可能会使测定结果偏低的是( )
| A. | 酸式滴定管只用水洗 | |
| B. | 锥形瓶只用水洗 | |
| C. | 使用甲基橙做指示剂 | |
| D. | 第一次观察酸式滴定管的刻度时仰视 |
18.下列反应中,反应后固体物质增重的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 碳与SiO2高温反应制粗硅 | ||
| C. | 将锌粒投入Cu(NO3)2溶液 | D. | 镁条在CO2中燃烧 |
15.分子式为C8H18的烷烃中,含有4个甲基的同分异构体的数目是( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
2.以下化学用语正确的是( )
| A. | 一CH3(甲基)的电子式为 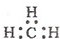 | B. | 硝基苯的结构简式: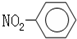 | ||
| C. | 甲醛的结构式: | D. | 乙醇的分子式:CH3CH2OH |
12.己烯雌酚是一种激素类药物,结构如下,下列有关叙述中不正确的是( ) 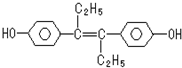

| A. | 该药物可以用有机溶剂萃取 | |
| B. | 可与NaOH反应但是不与Na2CO3发生反应 | |
| C. | 1mol该有机物不可以Br2发生取代反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
17.如图曲线a和b是盐酸与氢氧化钠溶液的相互滴定的滴定曲线,下列叙述正确的是( )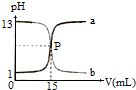

| A. | NaOH溶液的浓度为0.1 mol•L-1 | |
| B. | P点时恰好完全反应,溶液呈中性 | |
| C. | 曲线a是盐酸滴定氢氧化钠溶液的测定曲线 | |
| D. | 本实验的指示剂不能用甲基橙,只能用酚酞 |
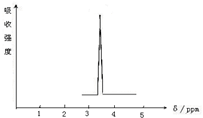 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.