题目内容
17.用盐酸标准液来滴定NaOH待测液,下列操作可能会使测定结果偏低的是( )| A. | 酸式滴定管只用水洗 | |
| B. | 锥形瓶只用水洗 | |
| C. | 使用甲基橙做指示剂 | |
| D. | 第一次观察酸式滴定管的刻度时仰视 |
分析 根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A、酸式滴定管只用水洗,注入标准溶液盐酸后,标准液的浓度偏小,造成V(标)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,则c(待测)偏大,故A错误;
B、锥形瓶只用水洗,待测液的物质的量无影响,V(标)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,则c(待测)不变,故B错误;
C、使用甲基橙做指示剂,甲基橙在酸性范围内变色,造成V(标)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,则c(待测)偏大,故C错误;
D、若第一次观察酸式滴定管的刻度时仰视,结束后观察酸式滴定管的刻度时平视,造成V(标)偏小,由c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,c(待测)偏小,故D正确;
故选:D.
点评 本题主要考查了中和滴定操作的误差分析,难度不大,注意把握误差分析的方法,侧重于考查学生的分析能力.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
9.欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.三种金属离子生成沉淀的pH如右表.
某含铬废水处理的主要流程如图所示:
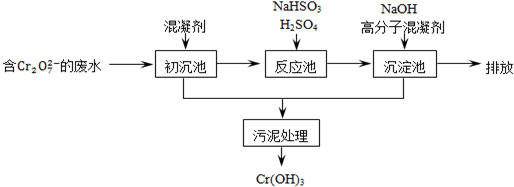
(1)Cr在周期表中的位置为第四周期第ⅥB族.
(2)初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)
Al3++3H2O?Al(OH)3+3H+.
(3)请补充并配平以下反应池中发生主要反应的离子方程式:
1Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(4)根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和Cr3++3OH-=Cr(OH)3↓.证明Cr3+沉淀完全的方法是取沉淀后的上层清液测定其pH,若pH≥8,则沉淀完全.
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |

(1)Cr在周期表中的位置为第四周期第ⅥB族.
(2)初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)
Al3++3H2O?Al(OH)3+3H+.
(3)请补充并配平以下反应池中发生主要反应的离子方程式:
1Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(4)根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和Cr3++3OH-=Cr(OH)3↓.证明Cr3+沉淀完全的方法是取沉淀后的上层清液测定其pH,若pH≥8,则沉淀完全.
 ;
;


 用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:

 .②的最高价氧化物的电子式是:
.②的最高价氧化物的电子式是: