题目内容
16.(1)①元素的第一电离能:Al<Si(填“>”或:“<”)基态Mn2+的核外电子排布式为[Ar]3d5.②硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图1所示,呈现这种变化关系的原因是因为硅烷都属于分子晶体,而分子晶体的熔沸点随着相对分子质量的增加,范德华力增强,熔沸点升高.

(2)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图2所示:
①硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有ADE(填序号).
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
②在Xm-中,硼原子轨道的杂化类型有sp2杂化、sp3杂化;配位键存在于4号与5号原子之间(填原子的数字标号);
③在Xm-中,m=2(填数字).
分析 (1)①同周期从左到右第一电离能逐渐增大趋势,ⅡA和ⅤA族则反常;根据Mn的核外电子排布式判断基态Mn2+的核外电子排布式;
②硅烷是分子晶体,结构相似,相对分子质量越大,分子间的范德华力越大,沸点越高;
(2)①注意题目要求,钠离子与Xm-形成离子键,结晶水分子间存在氢键和范德华力;
②1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间;
③结合化合价代数和为0的原则判断计算m的值.
解答 解:(1)①同周期从左到右第一电离能逐渐增大趋势,ⅡA和ⅤA族则反常,所以铝的第一电离能小硅;Mn的电子排布式为[Ar]3d54s2,则基态Mn2+的核外电子排布式为[Ar]3d5,故答案为:<;[Ar]3d5;
②硅烷是分子晶体,结构相似,相对分子质量越大,分子间的范德华力越大,沸点越高,故答案为:因为硅烷都属于分子晶体,而分子晶体的熔沸点随着相对分子质量的增加,范德华力增强,熔沸点升高;
(2)①钠离子与Xm-形成离子键,结晶水分子间存在氢键和范德华力,故答案为:ADE;
②1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间.故答案为:sp2杂化、sp3杂化;4号与5号;
③观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,故答案为:2.
点评 本题考查较为综合,题目难度中等,注意一般题目是比较镁铝的电离能,这样设问可见出题求异,主要考查思维能力,空间能力要求比较高,(4)中注意仔细读题,题目是问钠离子、Xm-、水分子之间的作用力,而不是硼砂晶体中的作用力,可能会多选B.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案| 选 项 | A | B | C | D |
| 物 质 | CaCl2 | H2O2 | H2SO4 | NH4Cl |
| 所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键、共价键 |
| 所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(1)Z位于元素周期表第三周期第ⅦA族,Y的氢化物电子式是
 .
.(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S,对应氢化物较稳定的是HCl.
(3)写出X的单质与Y的最高价氧化物对应水化物的浓溶液反应的方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(4)写出W元素的原子核外价电子排布式3d104s1.
| A. | 乙醇?乙醚 | B. | 乙醛?乙酸 | C. | 乙醛?乙醇 | D. | 乙酸?乙酸乙酯 |
| A. | L层电子数为奇数的所有元素都是非金属 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第3、4、5、6周期元素的数目分别是8、18、32、32 | |
| D. | 元素周期表中第8、9、12列没有非金属 |

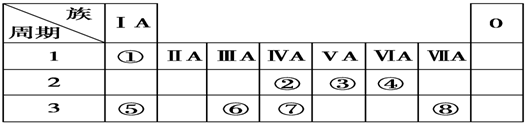
 .②的最高价氧化物的电子式是:
.②的最高价氧化物的电子式是:

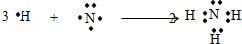 ;
; .
.