题目内容
19. 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是AD.
A.CH3CH3 B.CH3COOH C.CH3COOCH3 D.CH3OCH3
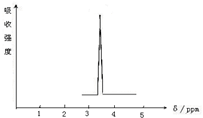
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:BrCH2CH2Br,请预测B的核磁共振氢谱上有2 个峰(信号).
分析 (1)核磁共振氢谱中峰值数等于有机物中氢原子的种类数.核磁共振氢谱中给出的峰值(信号)只有一个,说明该分子中只有1种H原子;
(2)核磁共振氢谱中峰值数等于有机物中氢原子的种类数,核磁共振氢谱中只给出一种峰,说明该分子中只有1种H原子,然后根据分子式写出对应的结构.
解答 解:(1)A.CH3CH3中只有一种H原子,故A正确;
B.CH3COOH中有两种H原子,故B错误;
C.CH3COOCH3中有两种H原子,故C错误;
D.CH3OCH3中只有一种H原子,故D正确;故选:AD.
(2)核磁共振氢谱中只给出一种峰,说明该分子中只有1种H原子,则A的结构简式为BrCH2CH2Br,B的结构简式为CH3CHBr2,有两种H原子,所以核磁共振氢谱上有2个峰,
故答案为:BrCH2CH2Br;2.
点评 本题结合核磁共振氢谱考查了有机物结构的书写,难度不大,要抓住核磁共振氢谱中峰值数等于有机物中氢原子的种类数.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.三种金属离子生成沉淀的pH如右表.
某含铬废水处理的主要流程如图所示:
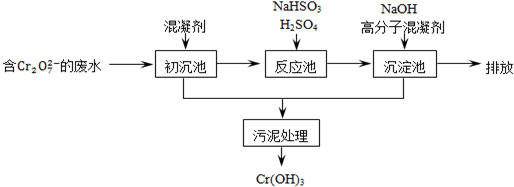
(1)Cr在周期表中的位置为第四周期第ⅥB族.
(2)初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)
Al3++3H2O?Al(OH)3+3H+.
(3)请补充并配平以下反应池中发生主要反应的离子方程式:
1Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(4)根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和Cr3++3OH-=Cr(OH)3↓.证明Cr3+沉淀完全的方法是取沉淀后的上层清液测定其pH,若pH≥8,则沉淀完全.
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |

(1)Cr在周期表中的位置为第四周期第ⅥB族.
(2)初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)
Al3++3H2O?Al(OH)3+3H+.
(3)请补充并配平以下反应池中发生主要反应的离子方程式:
1Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(4)根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和Cr3++3OH-=Cr(OH)3↓.证明Cr3+沉淀完全的方法是取沉淀后的上层清液测定其pH,若pH≥8,则沉淀完全.
10.下列性质可以证明某化合物内一定存在离子键的是( )
| A. | 可溶于水 | B. | 水溶液能导电 | C. | 熔融状态可导电 | D. | 熔点350℃ |
4.下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
| 选 项 | A | B | C | D |
| 物 质 | CaCl2 | H2O2 | H2SO4 | NH4Cl |
| 所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键、共价键 |
| 所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
8.下列过程属于氧化反应的是( )
| A. | 乙醇?乙醚 | B. | 乙醛?乙酸 | C. | 乙醛?乙醇 | D. | 乙酸?乙酸乙酯 |
9.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色 | |
| C. | 乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| D. | 苯酚中的羟基氢能与NaOH溶液反应,而醇羟基氢不能与NaOH溶液反应 |
 .②的最高价氧化物的电子式是:
.②的最高价氧化物的电子式是:
