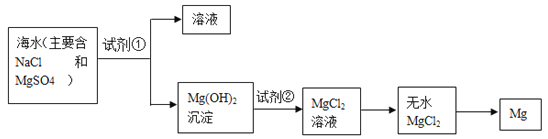
题目内容
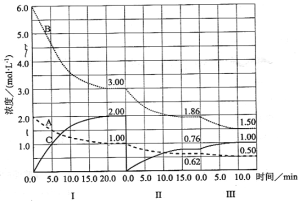
【题目】已知溶液中:还原性HSO3―>I―,氧化性IO3―>I2>>SO32―。向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示,下列说法正确的是

A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200ml 1mol/LKIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:
5HSO3-+2IO3-=I2+5SO42-+3H++H2O
【答案】D
【解析】
试题分析:还原性HSO-3>I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2。A.a点反应离子方程式为:3HSO3-+IO3-═3SO42-+I-+3H+,还原剂是NaHSO3,被氧化的元素是S元素,故A错误;B.b点反应的离子方程式是:3HSO3-+IO3-═3SO42-+I-+3H+,故B错误;C.c点到d点的反应离子方程式是IO3-+6H++5I-═3H2O+3I2,反应中生成0.3molI2,则转移电子为0.5mol,故C错误;D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,生成硫酸钠和单质碘,发生的反应为:5HSO3-+2IO3-═I2+5SO42-+3H++H2O,故D正确;故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
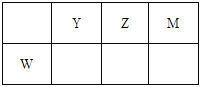
小学生10分钟应用题系列答案【题目】下表为元素周期表的一部分。
碳 | Y | Z | |
X | 硫 | W |
回答下列问题
(1)W元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)写出由上表中两种元素组成,可用作制冷剂的一种化合物的电子式__________。
(4)下列事实不能说明Z元素的非金属性比S元素的非金属性强的是__________;
A.Z单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1molY单质比1molS得电子多
C.Z和S两元素的简单氢化物受热分解,前者的分解温度高
(5)X与W两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式____________________。