��Ŀ����
����Ŀ���±�ΪԪ�����ڱ���һ���֡�
̼ | Y | Z | |
X | �� | W |
�ش���������
��1��WԪ�������ڱ��е�λ��Ϊ__________��
��2������Ԫ��ԭ�Ӱ뾶�����ǣ�дԪ�ط��ţ�__________��
��3��д�����ϱ�������Ԫ����ɣ��������������һ�ֻ�����ĵ���ʽ__________��
��4��������ʵ����˵��ZԪ�صķǽ����Ա�SԪ�صķǽ�����ǿ����__________��
A��Z������H2S��Һ��Ӧ����Һ�����
B����������ԭ��Ӧ�У�1molY���ʱ�1molS�õ��Ӷ�
C��Z��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
��5��X��W��Ԫ�صĵ��ʷ�Ӧ����1molX����ۻ�����ָ������£�����687kJ����֪�û�������ۡ��е�ֱ�Ϊ-69����58����д���÷�Ӧ���Ȼ�ѧ����ʽ____________________��
���𰸡���1���������ڣ���A�� ��1�֣� ��2��Si ��1�֣� ��3��![]() ��2�֣�
��2�֣�
��4��b��2�֣� ��5��Si(s)+2Cl2(g)=SiCl4(l) ��H��687 kJ/mol ��2�֣�
���������������������Ԫ�������ڱ��е�λ�ÿ��жϣ�X��Si��Y��N��Z��O��W��Cl��
��1����Ԫ�ص�ԭ��������17�������ڱ��е�λ��Ϊ�������ڵ���A�塣
��2��ͬ������������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶�����������Ԫ��ԭ�Ӱ뾶������Si��
��3��д�����ϱ�������Ԫ����ɣ��������������һ�ֻ������Ƕ�����̼�����й��ۼ��Ĺ��ۻ���������ʽΪ![]() ��
��
��4��A��������ǿ�ķǽ����������û����ǽ��������ģ�Z������H2S��Һ��Ӧ����Һ����ǣ�˵���������û���S�������Ԫ�صķǽ�����ǿ��S��a��ȷ��B���ǽ�����ǿ����õ����ӵĶ���û�й�ϵ��b����C��Z��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸߣ�˵��ǰ�ߵ��⻯���ȶ���ǿ���ǽ�����Խǿ���⻯��Խ�ȶ���c��ȷ����ѡb��
��5��X��W��Ԫ�صĵ��ʷ�Ӧ����1molX����ۻ�����ָ������£�����687kJ����֪�û�������ۡ��е�ֱ�Ϊ-69����58������˸÷�Ӧ���Ȼ�ѧ����ʽΪSi(s)+2Cl2(g)��SiCl4(l) ��H��687 kJ/mol��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����ˮ����þ��MgSO47H2O����ӡȾ����ֽ��ҽҩ�ȹ�ҵ�϶��й㷺��Ӧ�ã����û�����������ɰ�ķ�������þ�����ȡ��ˮ����þ����þ�����Ҫ�ɷ���MgCO3���������������ʣ�MgO��SiO2��Fe2O3��FeO��CaO��Al2O3��MnO�ȣ���
��1 ����������������������ʽ��ȫ����ʱ��Һ��pH
������ | Al��OH��3 | Fe��OH��3 | Fe��OH��2 | Mn��OH��2 | Mg��OH��2 | ||||||
pHֵ | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 | ||||||
��2 �����ε��ܽ�ȣ���λΪg/100gˮ��
�¶�/�� | 10 | 30 | 40 | 50 | 60 | ||||||||||||
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 | ||||||||||||
MgSO47H2O | 30.9 | 35.5 | 40.8 | 45.6 | / | ||||||||||||
��þ����ȡ��ˮ����þ�Ĺ����������£�
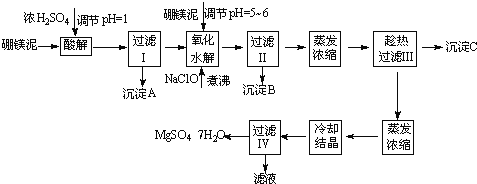
������������ͼ���ο�����pH���ݺ��ܽ�����ݣ��Իش��������⣺
��1������I����Һ�м�����þ�࣬������Һ��pH=5��6���ټ���NaClO��Һ������У�����Һ�е�Mn2+������MnO2����Ӧ�����ӷ�Ӧ����ʽΪ ��������е���ҪĿ���� ��
��2������B�г�MnO2��SiO2����� ���ѧʽ����������
��3��������ˢ�����Һ���Ƿ���Fe3+��ʵ�鷽���� ��
��4������C�Ļ�ѧʽ�� �����ˢ�����ȹ��˵������� ��
����Ŀ��ijС������H2C2O4��Һ������KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족��ʵ��ʱ���ȷֱ���ȡ������Һ��Ȼ�����Թ���Ѹ����Ͼ��ȣ���ʼ��ʱ��ͨ���ⶨ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������С����������·�����
��� | H2C2O4��Һ | ����KMnO4��Һ | |||
Ũ��/mol��L��1 | ���/mL | Ũ��/mol��L��1 | ���/mL | �¶ȡ� | |
�� | 0.10 | 2.0 | 0.010 | 4.0 | 20 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 20 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 40 |
��1��д���÷�Ӧ�Ļ�ѧ����ʽ ��
��2��̽���¶ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________(���ţ���ͬ)����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ���ʵ������____________��
��3��ʵ��ٲ��KMnO4��Һ����ɫʱ��Ϊ40s�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v(H2C2O4)��_____________mol��L��1��min��1��
��4�� �����������������䣬��ͼ�������߷ֱ��ʾ20����40��ʱc(MnO)����Ӧʱ��t�ı仯���ߡ�40��ʱc(MnO)��t�ı仯����Ϊ ������дA��B��