题目内容
【题目】下图是元素周期表的一部分,A、B、C、D、E、X 是元素周期表给出元素组成的常见单质或化合物。已知 A、B、C、D、E、X 存在如图所示转化关系(部分生成物和反应条件略去)。

(1)若 E 为氧化物,则 A 与水反应的方程式为____ ___,该反应中氧化剂和还原剂物质的量之比为__________ 。
①当 X 为碱性盐溶液,C 分子中有 22 个电子时,D 是__________(写化学式)。
②当 X 为金属单质时,X 与足量 B 的稀溶液反应生成 C 的离子方程式为________ __,写出检验生成物 C 的阳离子所用试剂的电子式__________。
(2)若 E 为单质气体,D 为白色沉淀,A 可能是________(写化学式), X是_______(写化学式)。
【答案】(1)3NO2+H2O = 2HNO3+NO 1 : 2 ① NaHCO3
②Fe+4H++NO3-= Fe3++NO↑+2H2O![]() (2)Na、Na2O2、NaH ;AlCl3或Al(NO3)3
(2)Na、Na2O2、NaH ;AlCl3或Al(NO3)3
【解析】试题分析:根据元素在周期表中的位置可判断元素的种类,①为H元素,②为Na元素,③为Al元素,④为C元素,⑤为N元素,⑥为O元素,⑦为Cl元素。
(1)若E为氧化物,根据转化关系以及元素种类可知,A为NO2,B为硝酸,NO2与水反应生成硝酸和一氧化氮,反应的方程式为3NO2+H2O = 2HNO3+NO,该反应中氧化剂是NO2,还原剂是NO2,N元素的化合价由+4价降低到+2价,发生还原反应,有+4价升高到+5价,发生氧化反应,则氧化剂与化合价的物质的量之比为1:2。
①X 为碱性盐溶液,C 分子中有 22 个电子,则C为CO2,X为碳酸钠,硝酸与碳酸钠反应生成二氧化碳,碳酸钠与CO2反应生成碳酸氢钠,则D 是NaHCO3。
②X为金属单质时,由转化图可知,应为Fe与稀硝酸反应生成硝酸铁,X与B的稀溶液反应生成C的离子方程式为Fe+4H++NO3-= Fe3++NO↑+2H2O;检验Fe3+的试剂是KSCN溶液,KSCN的电子式为![]() 。
。
(2)根据转化关系以及元素种类,若E为单质气体,则E为氢气或氧气,A为Na或Na2O2、NaH等,B为NaOH,D为白色沉淀,D为Al(OH)3,由![]() ,可以推知X为铝盐,C为偏铝酸盐,所以X是 AlCl3或 Al(NO3)3。
,可以推知X为铝盐,C为偏铝酸盐,所以X是 AlCl3或 Al(NO3)3。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】电子工业中,常用氯化铁溶液作为印刷电路铜板蚀刻液。请按要求回答下列问题:
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:______________________________________,该过程中调节溶液的pH为5,则c(Fe3+)为:____________mol·L-1。(己知:Ksp[Fe(OH)3]= 4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:
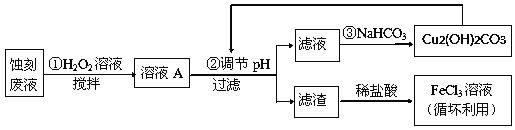
①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:_______________。
②FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:_________________。
③步骤①中加入H2O2溶液的目的是:______________________________________。
④已知:生成氢氧化物沉淀的pH
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.7 | 7.0 | 1.9 |
沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是:________________。
⑤写出步骤②中生成CO2的离子方程式:__________(已知Cu2(OH)2CO3难溶于水)。




