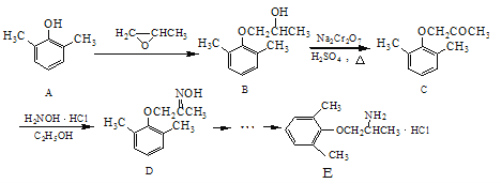
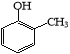
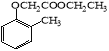题目内容
【题目】互称为同分异构体的物质不可能是( )
A.具有相同的相对分子质量 B.具有相同的结构
C.具有相同的通式 D.具有相同的分子式
【答案】B

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】电子工业中,常用氯化铁溶液作为印刷电路铜板蚀刻液。请按要求回答下列问题:
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:______________________________________,该过程中调节溶液的pH为5,则c(Fe3+)为:____________mol·L-1。(己知:Ksp[Fe(OH)3]= 4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:
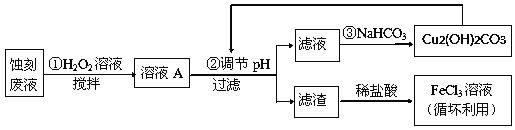
①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:_______________。
②FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:_________________。
③步骤①中加入H2O2溶液的目的是:______________________________________。
④已知:生成氢氧化物沉淀的pH
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.7 | 7.0 | 1.9 |
沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是:________________。
⑤写出步骤②中生成CO2的离子方程式:__________(已知Cu2(OH)2CO3难溶于水)。
【题目】七水硫酸镁(MgSO47H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 | ||||||
pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 | ||||||
表2 两种盐的溶解度(单位为g/100g水)
温度/℃ | 10 | 30 | 40 | 50 | 60 | ||||||||||||
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 | ||||||||||||
MgSO47H2O | 30.9 | 35.5 | 40.8 | 45.6 | / | ||||||||||||
硼镁泥制取七水硫酸镁的工艺流程如下:
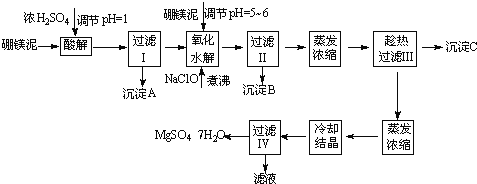
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 。
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 。
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | |||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | 温度℃ | |
① | 0.10 | 2.0 | 0.010 | 4.0 | 20 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 20 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 40 |
(1)写出该反应的化学方程式 。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=_____________mol·L-1·min-1。
(4) 若保持其他条件不变,下图两条曲线分别表示20℃和40℃时c(MnO)~反应时间t的变化曲线。40℃时c(MnO)~t的变化曲线为 。(填写A或B)