��Ŀ����
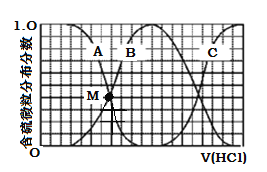
����Ŀ��I������A�����ᣬB�����ᣬC�����������ᣬ�������������ź�����������������������ա�
��1����ͬ�����ͬpH���������У��ֱ����������NaHCO3��ĩ������ͬ�����²���CO2������ɴ�С��˳���� ��
��2�����ʵ���Ũ�Ⱦ�Ϊ0.1 mol/L����������Һ��pH�ɴ�С��˳���� �����ȡ�������0.1 mol/L����������Һ����0.1 mol/L��NaOH�кͣ���ǡ����ȫ��Ӧʱ������NaOH��Һ������ɴ�С��˳���� ��
II����ʵ��ȷ��ij��HB��������ʡ���ͬѧ�ķ����ǣ�
�ף�����ȡһ��������HB����0.1mol/L����Һ100mL��
����pH��ֽ�������Һ��pHֵ������֤��HB�����������
�ң�������֪���ʵ���Ũ�ȵ�HB��Һ���������ֱ�����pH = 1����������Һ��100mL��
���ֱ�ȡ��������Һ��10mL����ˮϡ��Ϊ100mL��
����ȡ��ͬ���������ϡ��Һװ�������Թܣ�ͬʱ���봿����ͬ��п�����۲�������֤��HB�����������
��1���������У�˵��HB����������������������Һ��pH 1��ѡ�����������
��2����������������������ʵ��֮���Ͳ���֮���� ��
III�����ᣨH3BO3����������������Ļ���ԭ�ϡ���֪H3BO3�ĵ��볣��Ϊ5.8��10��10��H2CO3�ĵ��볣��ΪK1=4.4��10��7��K2=4.7��10��11����ʢ�б���������Һ���Թ���,�μ�0.1 mol/LNa2CO3��Һ�� (��ܡ����ܡ����۲쵽�����ݳ���
��֪H3BO3������NaOH��Һ��Ӧ�����ӷ���ʽΪH3BO3+OH��=B(OH)4����д��������ˮ��Һ�еĵ��뷽��ʽ ��
���𰸡�I����1��a��b��c ����2��a��b��c ��c��b��a ��
II ����1��������2������pH��1����Һ����ʵ�֣������п�����������������ͬ ��
III�������� H3BO3��H2O![]() B(OH)4����H����
B(OH)4����H����
��������
���������I����������ᶼ��һԪ�ᣬ���������ᣬ������ǿ�ᣬ�����Ƕ�Ԫǿ�ᣬ���Դ����д��ڵ���ƽ�⣬�Ȼ����������ȫ���롣��1��ͬ�����ͬpH���������У�����������������ӵ����ʵ�����ȣ�������Һ�д�������ʵ����������ᣬ�ֱ����������̼���Ʒ�ĩ�������ӵ����ʵ���Խ�����ɵĶ�����̼���Խ����������������ɵĶ�����̼�����ͬ�����������ɵĶ�����̼��������������ͬ�����²���CO2������ɴ�С��˳����a��b=c����2��������Ũ��Խ����Һ��pHԽС�����ʵ���Ũ��Ϊ0.1molL-1����������Һ��������������Ũ�����������������Ũ�ȴ�֮��������������Ũ����С��������������Һ��pH�ɴ�С��˳����a��b��c������ʹ��ᶼ��һԪ�ᣬ�����Ƕ�Ԫ�ᣬ������������ʵ���Ũ�ȵ���������Ӧʱ�����ļ�����ʵ�����������ʵ�����Ԫ�������ȣ�����������������������࣬����ʹ��������������Ƶ�����ȣ��� c��a=b��II����1��������ˮ��Һ�ﲿ�ֵ��룬����������Ũ��С����Ũ�ȣ�������������ᣬ��0.1mol/L��HB��Һ��pH��1����2��HB��������ڵ���ƽ�⣬��������pH=1��HA��Һ����ʵ�֣���Ӧ��ĽӴ�����뷴Ӧ���ʳ����ȣ�п���ı������С���Կ��ƣ�����ʵ�ֽ����ѡ��ʴ�Ϊ������pH=1��HA��Һ����ʵ�֣�����п�����������������ͬ��III����1��H3BO3�ĵ��볣��Ϊ5.8��10-10 ��H2CO3�ĵ��볣��ΪK1=4.4��10-7����5.8��10-10��4.4��10-7�����Բ��ܹ۲쵽�����ݳ�����2�������������ǻ���������������ӣ�����ʽΪ��H3BO3��H2O![]() B(OH)4����H����
B(OH)4����H����

����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2(g)+H2(g) ![]() CO(g)+H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO(g)+H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
��ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK�� ��
��2���÷�ӦΪ ��Ӧ��������������������������
��3��830������1L�Ĺ̶��������ܱ������з���1 mol CO��5 mol H2O����Ӧ��ƽ����仯ѧƽ�ⳣ��K 1.0����������������С����������������
��4��830���������еķ�Ӧ�ﵽƽ�⡣�������������������£����������������ƽ�� �ƶ��������������������������淽��������������
��5����1200��ʱ����ijʱ�̸�������CO2��H2��CO��H2O��Ũ�ȷֱ�Ϊ2 mol��L��1��2 mol��L��1��4 mol��L��1��4 mol��L��1�����ʱ������Ӧ��ƽ���ƶ�����Ϊ ��ѡ��������Ӧ�����������淴Ӧ�������������ƶ�������