题目内容
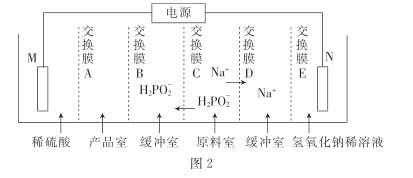
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
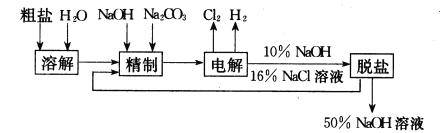
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应式为__________。 与电源负极相连的电极附近,溶液pH ________(选填:不变,升高或下降)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为___________,
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是______。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 _________。
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、_________(填写操作名称)除去NaCl。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为_____。
【答案】2Cl--2e-=Cl2↑ 升高 Ca2++ CO32-= CaCO3↓;Mg2++2OH- =Mg(OH)2↓ ac bc 蒸发 过滤 NaCl+H2O![]() NaClO+H2↑
NaClO+H2↑
【解析】
(1)电解过程中,与电源正极连接的电极为阳极,阳极上Cl-失去电子发生氧化反应;与电源负极连接的电极为阴极,阴极上溶液中的H+得到电子被还原为H2,同时附近溶液中生成NaOH;
(2)用可溶性的碳酸钠除去Ca2+,用NaOH除去Mg2+;
(3)添加Ba2+除去SO42-,注意不能引入新的杂质;
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在含钡离子的试剂之后;
(5)根据氯化钠的溶解度随温度变化不大的特征进行分析;
(6)根据反应物和生成物写出反应方程式。
(1)电解食盐水,与电源正极相连的电极为阳极,阳极Cl-失去电子,发生氧化反应,电极反应式为:上所发生反应式为2Cl--2e-=Cl2↑,与电源负极相连为阴极,阴极上溶液水电离产生的H+得到电子变为H2,同时附近溶液生成NaOH,使溶液中c(OH-)增大,所以溶液pH升高;
(2)杂质Ca2+用Na2CO3除去,杂质Mg2+用NaOH除去,反应的离子反应分别为Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓;
(3)如果粗盐中SO42-过高,除去SO42-要使用Ba2+,使SO42-转化为BaSO4沉淀,不能引入新的杂质,由于除去Mg2+要使用NaOH,使用试剂若是Ba(NO3)2,就会引入杂质离子NO3-,所以合理选项是ac;
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的Ba2+,显然选项bc符合,故合理选项是bc;
(5)因为NaCl的溶解度受温度影响变化不大,而NaOH的溶解度受温度的影响变化较大,所以可以采用蒸发溶剂结晶的方法,然后过滤制得晶体,从而除去氢氧化钠中的氯化钠;
(6)若氯气和氢氧化钠充分接触,产物仅是次氯酸钠和氢气,则发生的反应为:NaCl+H2O ![]() NaClO+H2↑。
NaClO+H2↑。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案