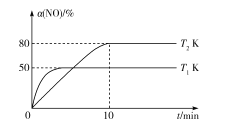
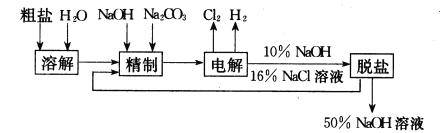
题目内容
【题目】锂因其重要的用途,被誉为“能源金属”和“推动世界前进的金属”.
(1)Li3N可由Li在N2中燃烧制得.取4.164g 锂在N2中燃烧,理论上生成Li3N__g;因部分金属Li没有反应,实际反应后固体质量变为6.840g,则固体中Li3N的质量是__g(保留三位小数,Li3N的式量:34.82)
(2)已知:Li3N+3H2O→3LiOH+NH3↑.取17.41g纯净Li3N,加入100g水,充分搅拌,完全反应后,冷却到20℃,产生的NH3折算成标准状况下的体积是__L.过滤沉淀、洗涤、晾干,得到LiOH固体26.56g,计算20℃时LiOH的溶解度__.(保留1位小数,LiOH的式量:23.94)
锂离子电池中常用的LiCoO2,工业上可由碳酸锂与碱式碳酸钴制备.
(3)将含0.5molCoCl2的溶液与含0.5molNa2CO3的溶液混合,充分反应后得到碱式碳酸钴沉淀53.50g;过滤,向滤液中加入足量HNO3酸化的AgNO3溶液,得到白色沉淀143.50g,经测定溶液中的阳离子只有Na+,且Na+有1mol;反应中产生的气体被足量NaOH溶液完全吸收,使NaOH溶液增重13.20g,通过计算确定该碱式碳酸钴的化学式__,写出制备碱式碳酸钴反应的化学方程式__.
(4)Co2(OH)2CO3和Li2CO3在空气中保持温度为600~800℃,可制得LiCoO2,已知: 3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
按钴和锂的原子比1:1混合固体,空气过量70%,800℃时充分反应,计算产物气体中CO2的体积分数__.(保留三位小数,已知空气组成:N2体积分数0.79,O2体积分数0.21)
【答案】6.964 6.656 11.2 12.8g 2CoCO33Co(OH)2H2O 5CoCl2+5Na2CO3+4H2O=2CoCO33Co(OH)2H2O+10NaCl+3CO2↑ 0.305
【解析】
(1)首先写出锂在氮气中燃烧的方程式:![]() ,接下来根据
,接下来根据![]() 算出锂的物质的量,则理论上能生成0.2mol的氮化锂,这些氮化锂的质量为
算出锂的物质的量,则理论上能生成0.2mol的氮化锂,这些氮化锂的质量为![]() ;反应前后相差的质量为
;反应前后相差的质量为![]() ,这些增加的质量实际上是氮原子的质量,即
,这些增加的质量实际上是氮原子的质量,即![]() 的氮原子,根据氮守恒我们知道氮化锂的物质的量也为
的氮原子,根据氮守恒我们知道氮化锂的物质的量也为![]() ,这些氮化锂的质量为
,这些氮化锂的质量为![]() ;
;
(2)根据![]() 先算出氮化锂的物质的量,根据方程式不难看出氮化锂和氨气是1:1的,这些氨气在标况下的体积为
先算出氮化锂的物质的量,根据方程式不难看出氮化锂和氨气是1:1的,这些氨气在标况下的体积为![]() ;根据化学计量比,0.5mol的氮化锂理论上能生成1.5mol的
;根据化学计量比,0.5mol的氮化锂理论上能生成1.5mol的![]() ,这些
,这些![]() 的质量为
的质量为![]() ,缺少的那9.35克
,缺少的那9.35克![]() 即溶解损失掉的,但是需要注意:溶解度指的是100克溶剂能溶解达到饱和的最大溶质的量,虽然一开始有100克水,但是反应会消耗掉1.5mol水,这些水的质量为
即溶解损失掉的,但是需要注意:溶解度指的是100克溶剂能溶解达到饱和的最大溶质的量,虽然一开始有100克水,但是反应会消耗掉1.5mol水,这些水的质量为![]() ,因此我们算出的9.35克是73克水中能溶解的
,因此我们算出的9.35克是73克水中能溶解的![]() 的量,换算一下
的量,换算一下![]() ,解得S为12.8克;
,解得S为12.8克;
(3)加入硝酸银后的白色沉淀为![]() ,根据
,根据![]() 算出
算出![]() 的物质的量,因此
的物质的量,因此![]() 全部留在溶液中,碱式碳酸钴中无
全部留在溶液中,碱式碳酸钴中无![]() ,
,![]() 也全部留在溶液中,沉淀中无
也全部留在溶液中,沉淀中无![]() ,使烧碱溶液增重是因为吸收了
,使烧碱溶液增重是因为吸收了![]() ,根据
,根据![]() 算出
算出![]() 的物质的量,根据碳守恒,剩下的
的物质的量,根据碳守恒,剩下的![]()
![]() 进入了碱式碳酸钴中,0.5mol
进入了碱式碳酸钴中,0.5mol![]() 全部在碱式碳酸钴中,剩下的负电荷由
全部在碱式碳酸钴中,剩下的负电荷由![]() 来提供,因此
来提供,因此![]() 的物质的量为0.6mol。将0.5mol
的物质的量为0.6mol。将0.5mol![]() 、0.2mol
、0.2mol![]() 和0.6mol
和0.6mol![]() 的质量加起来,发现只有
的质量加起来,发现只有![]() ,剩下的1.8克只能是结晶水,即0.1mol结晶水,综上,碱式碳酸钴的分子式为
,剩下的1.8克只能是结晶水,即0.1mol结晶水,综上,碱式碳酸钴的分子式为![]() ;写出制备方程式
;写出制备方程式![]() ;
;
(4)令参加反应的氧气为3mol,相当于![]() 的空气,又因为空气过量70%,则一共通入了
的空气,又因为空气过量70%,则一共通入了![]() 空气,反应中一共生成了6mol水蒸气和12mol二氧化碳,则二氧化碳的体积分数为
空气,反应中一共生成了6mol水蒸气和12mol二氧化碳,则二氧化碳的体积分数为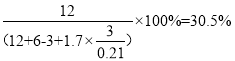 。
。

【题目】工业上CO2、CH4等含碳化合物有着重要的应用。
(1)科学家以CH4为原料来制备乙烯,同时得到氢气。已知相关物质的标准燃烧热如下表所示,写出甲烷制备乙烯的热化学方程式:__。
物质 | 标准燃烧热/kJ·mol-1 |
氢气 | -285.8 |
甲烷 | -890.3 |
乙烯 | -1411.0 |
(2)在400℃时,向初始体积为1L的恒容密闭反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0%。
①该温度下,平衡常数K=__。
②若向该平衡体系中充入等物质的量的CH4和H2,则平衡将___(填“正向移动”或“逆向移动”或“不移动”成“无法确定”),理由是__。
(3)科学家用氮化镓材料与铜组装成如图所示的人工光合系统实现CO2的再利用。
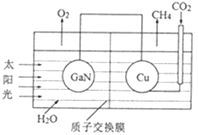
①该电化学装置属于__(填“原电池”或“电解池”)。
②该电池的Cu电极上发生反应的电极方程式为__。
【题目】回答下列问题:
(1)基态碳原子的核外电子排布式为______。非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是______(填序号)。
A.甲的金属性比乙强
B.乙有![]() 价
价
C.丙不可能为非金属元素
D.丁一定为金属元素
(3)![]() 、
、![]() 均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 |
|
| |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态![]() 的价电子排布式:______,比较两元素的I2、I3可知,气态
的价电子排布式:______,比较两元素的I2、I3可知,气态![]() 再失去1个电子比气态
再失去1个电子比气态![]() 再失去1个电子难,对此你的解释是______。
再失去1个电子难,对此你的解释是______。
(4)卤族元素![]() 、
、![]() 、
、![]() 、
、![]() 的电负性由小到大的顺序是______。
的电负性由小到大的顺序是______。
(5)基态![]() 原子的电子排布式为______;
原子的电子排布式为______;![]() 和
和![]() 相比,电负性较大的是______;
相比,电负性较大的是______;![]() 中
中![]() 元素的化合价为______。
元素的化合价为______。