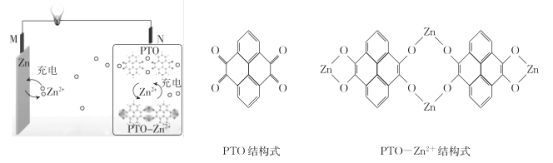
题目内容
【题目】Ⅰ.已知NH3H2O与醋酸的电离度在同温同浓度下相等。向少量Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,结果固体完全溶解。
甲同学的解释是:
Mg(OH)2 (固)![]() Mg2++2OH- (1)
Mg2++2OH- (1)
NH4++H2O![]() NH3H2O+H+ (2)
NH3H2O+H+ (2)
H++OH-![]() H2O (3)
H2O (3)
由于(3)的发生,使平衡(1)右移,沉淀溶解。
乙同学的解释是:
Mg(OH)2 (固)![]() Mg2++2OH- (1)
Mg2++2OH- (1)
NH4Cl=NH4++Cl- (2)
NH4++OH-![]() NH3H2O (3)
NH3H2O (3)
由于(3)的发生,使平衡(1)右移,沉淀溶解。
丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确。
(1)他选用的试剂是__________(填写编号)。
A. NH4NO3 B. CH3COONH4 C. Na2CO3 D. NH3H2O
(2)实验步骤:____________________________;
(3)实验结论:____________________________。
Ⅱ.关于“电解氯化铜溶液时的pH变化”问题,化学界有两种不同的观点。
观点一:“理论派”认为电解氯化铜溶液后溶液的pH升高;
观点二:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时的pH的变化如图。请回答下列问题:
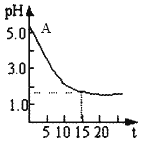
(1)用离子方程式表示电解前氯化铜溶液的pH处于A点的原因:______________。
(2)“理论派”所持观点的理论依据是:_______________________。
(3)你支持哪种观点:_________(理论派、实验派)。其理由是_____________。
【答案】B 向Mg(OH)2悬浊液中加入适量的饱和醋酸铵CH3COONH4溶液,振荡,观察Mg(OH)2是否溶解 若Mg(OH)2溶解,则乙同学的解释正确;若Mg(OH)2不溶解,则甲同学的解释正确 Cu2++2H2O![]() Cu(OH)2+2H+ 随着电解的进行,c(Cu2+)减少,水解平衡向逆方向移动,c(H+)下降,pH增大 实验派 电解时阳极产生的Cl2溶解生成HCl和HClO,使溶液c(H+)增大,pH减小
Cu(OH)2+2H+ 随着电解的进行,c(Cu2+)减少,水解平衡向逆方向移动,c(H+)下降,pH增大 实验派 电解时阳极产生的Cl2溶解生成HCl和HClO,使溶液c(H+)增大,pH减小
【解析】
I.为了证明Mg(OH)2悬浊液与氯化铵溶液的反应原理,可加入醋酸铵溶液检验,因醋酸铵溶液呈中性,如甲同学的解释正确,则氢氧化镁不溶解,如氢氧化镁溶解,则乙同学的解释正确,据此进行解答;
II.(1)根据盐的类型判断溶液的酸碱性;
(2)根据水解平衡的移动判断氢离子的浓度变化,从而判断pH值变化;
(3)根据电解生成物的性质判断溶液的酸碱性;
I.硝酸铵和氯化铵相似,只有铵根离子的水解,而碳酸钠和氨水溶液都呈碱性,只有CH3COONH4溶液显中性,可证明是否由于铵根离子水解呈酸性的原因导致氢氧化镁溶解,可以证明是甲合理还是乙合理,故合理选项是B;
(2)实验步骤:向Mg(OH)2悬浊液中加入适量的饱和醋酸铵CH3COONH4溶液,振荡,观察Mg(OH)2是否溶解;
(3)实验结论:若Mg(OH)2溶解,则乙同学的解释正确;若Mg(OH)2不溶解,则甲同学的解释正确;
II.(1)电解前氯化铜溶液pH=5,是由于氯化铜是强酸弱碱盐,溶于水,Cu2+能发生水解作用:Cu2++H2O![]() Cu(OH)2+2H+,当最终达到平衡时,溶液中氢离子浓度大于氢氧根离子浓度,所以溶液呈酸性pH<7;
Cu(OH)2+2H+,当最终达到平衡时,溶液中氢离子浓度大于氢氧根离子浓度,所以溶液呈酸性pH<7;
(2)随着电解的进行,溶液中Cu2+不断形成Cu(OH)2析出,溶液中铜离子浓度逐渐降低,使反应Cu2++H2O![]() Cu(OH)2+2H+向逆反应方向进行,c(H+)下降,溶液的pH增大;
Cu(OH)2+2H+向逆反应方向进行,c(H+)下降,溶液的pH增大;
(3)电解氯化铜生成氯气和铜,氯气易溶于水,与水反应生成盐酸和次氯酸,使溶液酸性增强,所以pH降低,所以我支持的观点是实验派。

 阅读快车系列答案
阅读快车系列答案【题目】(1)某元素原子共有3个价电子,其中一个价电子位于第三能层![]() 能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
(2)![]() 、
、![]() 均为短周期金属元素。依据下表数据,写出
均为短周期金属元素。依据下表数据,写出![]() 原子的核外电子排布式:______。
原子的核外电子排布式:______。
电离能/ |
|
|
|
|
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |