题目内容
16.常温下,下列水溶液pH<7的是( )| A. | Na2CO3 | B. | NH4Cl | C. | NaCl | D. | Na2SO4 |
分析 常温下,电解质溶液的水溶液pH<7,说明溶液呈酸性,溶液中的溶质可能是酸、强酸强碱酸式盐、强酸弱碱盐,据此分析解答.
解答 解:常温下,电解质溶液的水溶液pH<7,说明溶液呈酸性,溶液中的溶质可能是酸、强酸强碱酸式盐、强酸弱碱盐,
A.碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,pH>7,故A错误;
B.氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,pH<7,故B正确;
C.氯化钠是强酸强碱盐,钠离子和氯离子都不水解,溶液呈中性,pH=7,故C错误;
D.硫酸钠是强酸强碱盐,钠离子和硫酸根离子都不水解,溶液呈中性,pH=7,故D错误;
故选B.
点评 本题以溶液酸碱性判断为载体考查盐类水解,明确盐的性质是解本题关键,知道盐的水解中存在“谁弱谁水解、谁强谁显性、越弱越水解、强强显中性”,题目难度不大.

练习册系列答案
相关题目
6.下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
(1)请写出上述元素d3+的核外电子排布式1s222s2p63s23p63d5;
(2)请写出j的单质与a、h形成的化合物发生反应的化学方程式Cl2+H2O=HCl+HClO;
(3)请比较b、e、j三种元素的电负性由大到小的顺序Cl>Al>Mg(写元素符号);此三种元素的第一电离能由大到小的顺序Cl>Mg>Al(写元素符号);
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O;
(5)j、k、l三种元素之间能以原子个数比1:1两两形成互化物,这些互化物的性质类似于这些元素单质的性质.请写出k、l的互化物的电子式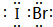 ,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).
,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).
| a | |||||||||||||||||
| f | h | i | |||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | k | ||||||||||||||
| l | |||||||||||||||||
(2)请写出j的单质与a、h形成的化合物发生反应的化学方程式Cl2+H2O=HCl+HClO;
(3)请比较b、e、j三种元素的电负性由大到小的顺序Cl>Al>Mg(写元素符号);此三种元素的第一电离能由大到小的顺序Cl>Mg>Al(写元素符号);
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O;
(5)j、k、l三种元素之间能以原子个数比1:1两两形成互化物,这些互化物的性质类似于这些元素单质的性质.请写出k、l的互化物的电子式
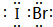 ,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).
,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).
7.钠、镁、铝三种金属单质的混合物跟足量的稀硫酸溶液充分反应后,得到标准状况下的氢气2.24L,则这三种金属的总物质的量可能是( )
| A. | 0.050 mol | B. | 0.060 mol | C. | 0.100 mol | D. | 0.200 mol |
4.下列物质的电子式书写正确的是( )
| A. | 氯化氢  | B. | 二氧化碳  | ||
| C. | 氮气  | D. | 氯化镁  |
11.要增大过量Zn 和一定量稀 H2SO4间反应生成氢气的速率,下列措施正确的是( )
| A. | 使用高纯度的锌粒 | B. | 滴加几滴硫酸铜溶液 | ||
| C. | 使用浓H2SO4 | D. | 使用浓HNO3 |
1.下列事实不能用勒夏特列原理解释的是( )
| A. | 增大压强能缩短碘化氢分解反应达到平衡的时间 | |
| B. | 配制硫酸铁溶液时,向溶液中加入少量硫酸 | |
| C. | 往醋酸溶液中加碱溶液,使c(CH3COO-) 增大 | |
| D. | 向水中加入酸可抑制水的电离 |
8.某有机物具有下列性质:能发生银镜反应;滴入石蕊试液不变色;加入少量碱液并滴入酚酞试液,共煮时红色逐渐消失.该有机物可能是( )
| A. | 甲酸乙酯 | B. | 甲酸 | C. | 乙酸 | D. | 乙酸甲酯 |
5.下列物质中互为同分异构体的是( )
| A. | 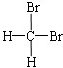 与 与 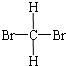 | B. | 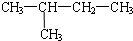 与 与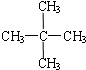 | C. | CH4和CH3CH3 | D. | 淀粉和纤维素 |
6.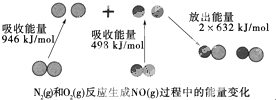 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |