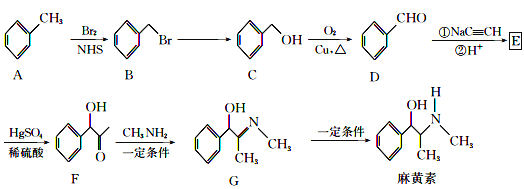
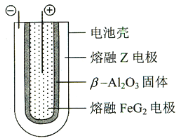
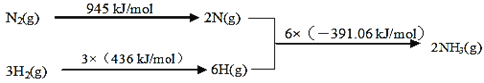
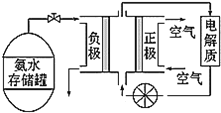
题目内容
【题目】甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是( )
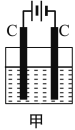
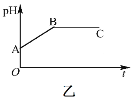
A.是该混合溶液中的SO42-导致了A点溶液的pH值小于B点
B.AB线段与BC线段在阴极上发生的反应是相同的,即:Cu2+ + 2e=Cu
C.BC段阴极产物和阳极产物的体积之比为2:1
D.在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀
【答案】C
【解析】
假设溶液中n(CuSO4)=1mol、n(NaCl)=2mol,电解初始,阳极上氯离子放电、阴极上铜离子放电,当转移2mol电子时,阴极上铜离子完全放电生成Cu、阳极上氯离子完全放电生成氯气,溶液中的溶质之间变为硫酸钠,当铜离子、氯离子完全放电后,继续电解,实际上是电解水,溶液的pH不变,据以上分析解答。
A. 硫酸铜是强酸弱碱盐,铜离子水解导致溶液呈酸性,B点铜离子和氯离子完全放电,溶液中的溶质为强酸强碱盐硫酸钠,所以A点pH小于B点,A项错误;
B. AB段是电解CuCl2,BC段是电解H2O,AB段阴极电极反应式为Cu2++2e-=Cu,BC段阴极电极反应式为2H++2e-=H2↑,B项错误;
C. BC段是电解水,阴极上生成氢气、阳极上生成氧气,所以阴极产物和阳极产物的体积之比为2:1,C项正确;
D. 整个电解过程中溶液不呈碱性,所以不会出现氢氧化铜蓝色沉淀,D项错误;
答案选C。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目