题目内容
【题目】某无色透明溶液中可能大量存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种离子。从其中取100mL,等分成两份进行如下实验:
中的几种离子。从其中取100mL,等分成两份进行如下实验:
(1)不做任何实验就可以肯定原溶液中不存在的两种离子,其氧化性______![]() ______
______![]() 填写离子符号
填写离子符号![]() ,能说明上述结论的离子方程式是______。
,能说明上述结论的离子方程式是______。
(2)取其中的一份进行实验,加入过量氢氧化钠溶液并加热,生成气体![]() 。取其中的一份加入过量
。取其中的一份加入过量![]() ,生成白色沉淀
,生成白色沉淀![]() ,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀2.33g。说明原溶液中肯定有的离子是______,沉淀溶解的离子反应式为______。
,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀2.33g。说明原溶液中肯定有的离子是______,沉淀溶解的离子反应式为______。
(3)综上可知溶液中必定还存在______,且浓度范围为______。
(4)溶液中还可能存在的阳离子有______,检验的操作为______。
【答案】![]()
![]()
![]()
![]() 、
、![]()
![]()
![]()
![]()
![]() 用铂丝或光洁无锈的铁丝蘸取试液,在酒精灯火焰上灼烧,观察焰色
用铂丝或光洁无锈的铁丝蘸取试液,在酒精灯火焰上灼烧,观察焰色
【解析】
(1)无色透明溶液中不能大量存在有色离子:![]() 、
、![]() ,其氧化性
,其氧化性![]() ,在氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,根据反应:
,在氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,根据反应:![]() 可以证明,故答案为:
可以证明,故答案为:![]() 、
、![]() ,
,![]() ;
;
(2)取其中的一份进行实验,加入过量氢氧化钠溶液并加热,生成气体![]() ,即为氨气,一定含有
,即为氨气,一定含有![]() ,取其中的一份加入过量
,取其中的一份加入过量![]() ,生成白色沉淀
,生成白色沉淀![]() ,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀
,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀![]() ,则一定含有
,则一定含有![]() 、
、![]() ,碳酸钡溶于盐酸
,碳酸钡溶于盐酸![]() ,但是硫酸钡不溶,故答案为:
,但是硫酸钡不溶,故答案为:![]() 、
、![]() ;
;![]() ;
;
(3)生成气体![]() ,即为氨气,一定含有
,即为氨气,一定含有![]() ,生成白色沉淀
,生成白色沉淀![]() ,是碳酸钡和硫酸钡的混合物,一定含有
,是碳酸钡和硫酸钡的混合物,一定含有![]() 、
、![]() ,余下沉淀
,余下沉淀![]() 是硫酸钡,物质的量是
是硫酸钡,物质的量是![]() ,所以含有硫酸根离子是
,所以含有硫酸根离子是![]() ,碳酸钡是
,碳酸钡是![]() ,碳酸根的物质的量是
,碳酸根的物质的量是![]() ,一定不含
,一定不含![]() 、
、![]() 、
、![]() ,根据电荷守恒可知溶液中必定还存在
,根据电荷守恒可知溶液中必定还存在![]() ,由于钠离子不能确定,则硝酸根离子的物质的量
,由于钠离子不能确定,则硝酸根离子的物质的量![]() ,浓度
,浓度![]() ,故答案为:
,故答案为:![]() ,
,![]() ;
;
(4)溶液中还可能存在的阳离子有![]() ;检验方法:用铂丝或光洁无锈的铁丝蘸取试液,在酒精灯火焰上灼烧,观察焰色,故答案为:
;检验方法:用铂丝或光洁无锈的铁丝蘸取试液,在酒精灯火焰上灼烧,观察焰色,故答案为:![]() ;用铂丝或光洁无锈的铁丝蘸取试液,在酒精灯火焰上灼烧,观察焰色。
;用铂丝或光洁无锈的铁丝蘸取试液,在酒精灯火焰上灼烧,观察焰色。

 阅读快车系列答案
阅读快车系列答案【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ||
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原无水FeCl3制取FeCl2的化学方程式为_____________。
②按气流由左到右的方向,上述仪器的连接顺序为_________(填字母,装置可多次使用);C中盛放的试剂是_____________。
③该制备装置的缺点为________________。
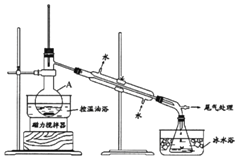
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

①仪器a的名称是__________。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____,回收滤液中C6H5C1的操作方法是______。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为__________。
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:________(写出一点即可)。