题目内容
【题目】1-溴丙烷是一种重要的有机合成中间体。实验室制备少量1-溴丙烷的主要步骤如下:
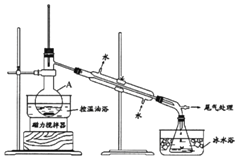
步骤1:在仪器A中加入搅拌磁子、12g 1-丙醇及20mL水,在冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr。
步骤2:缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分离出有机相。
步骤4:将分离出的有机相转入分液漏斗,依次用H2O、5%的Na2CO3溶液洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
已知:①1-溴丙烷沸点为71℃,密度为1.36g/cm3;
②反应过程中,在仪器A中可以观察到A的上方出现红棕色蒸气(Br2)。
回答下列问题:
(1)仪器A的名称是______;加入搅拌磁子的目的是搅拌和______。
(2)仪器A中主要发生反应为:NaBr + H2SO4===HBr + NaHSO4和______。
(3)步骤2中需向接收瓶内加入少量冰水并置于冰水浴中的目的是______,同时可以观察到的现象是______。
(4)步骤4中的两次洗涤,依次洗去的主要杂质是______、_________。
(5)步骤4中的Na2CO3溶液还可以用下列中的______试剂代替。
A.NaOH溶液 B.NaI溶液 C.Na2SO3溶液 D.CCl4
【答案】蒸馏烧瓶 防止暴沸 CH3CH2CH2OH + HBr ![]() CH3CH2CH2Br + H2O 冷凝1-溴丙烷,减少其挥发 溶液分层,下层为橙色的油状液体 1-丙醇 Br2 C
CH3CH2CH2Br + H2O 冷凝1-溴丙烷,减少其挥发 溶液分层,下层为橙色的油状液体 1-丙醇 Br2 C
【解析】
(1)仪器A的名称是蒸馏烧瓶;溶液受热易发生暴沸;
(2)仪器A中主要反应为浓硫酸与溴化钠反应生成溴化氢和硫酸氢钠,反应生成的溴化氢,在浓硫酸作用下,与1-丙醇共热发生取代反应生成1-溴丙烷和水;
(3)1-溴丙烷沸点低,受热易挥发,不溶于水且比水密度大,单质溴易溶于有机溶剂;
(4)由于制得的1-溴丙烷中混有挥发出的1-丙醇和单质溴;
(5)1-溴丙烷在NaOH溶液中发生水解反应;反应生成的单质碘溶于1-溴丙烷引入新杂质;单质溴能与亚硫酸钠溶液发生氧化还原反应,且不与1-溴丙烷反应;1-溴丙烷与四氯化碳互溶。
(1)由图可知,仪器A的名称是蒸馏烧瓶;加入搅拌磁子的目的是搅拌和防止溶液受热暴沸,故答案为:蒸馏烧瓶;防止暴沸;
(2)仪器A中主要反应为浓硫酸与溴化钠反应生成溴化氢和硫酸氢钠,反应生成的溴化氢,在浓硫酸作用下,与1-丙醇共热发生取代反应生成1-溴丙烷和水,有关化学方程式为NaBr + H2SO4=HBr + NaHSO4和CH3CH2CH2OH + HBr ![]() CH3CH2CH2Br + H2O,故答案为:CH3CH2CH2OH + HBr
CH3CH2CH2Br + H2O,故答案为:CH3CH2CH2OH + HBr ![]() CH3CH2CH2Br + H2O;
CH3CH2CH2Br + H2O;
(3)由题给信息可知,1-溴丙烷沸点低,受热易挥发,则步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是减少1-溴丙烷的挥发;实验时,浓硫酸和溴化氢发生氧化还原反应生成了单质溴,单质溴易溶于有机溶剂,1-溴丙烷不溶于水且比水密度大,溶液分层,溴溶于下层1-溴丙烷,使下层油状液体呈橙色,故答案为:冷凝1-溴丙烷,减少其挥发;溶液分层,下层为橙色的油状液体;
(4)由于制得的1-溴丙烷中混有挥发出的1-丙醇和单质溴,步骤4中用H2O洗去溶于水的1-丙醇,用5%的Na2CO3溶液洗去能与Na2CO3溶液反应的单质溴,故答案为:1-丙醇;Br2;
(5)A、1-溴丙烷在NaOH溶液中发生水解反应生成1-丙醇,故错误;
B、单质溴能与碘化钠溶液发生置换反应生成单质碘,单质碘溶于1-溴丙烷引入新杂质,故错误;
C、单质溴能与亚硫酸钠溶液发生氧化还原反应,且不与1-溴丙烷反应,故正确;
D、1-溴丙烷与四氯化碳互溶,故错误;
C正确,故答案为:C。

【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如下图所示:用离子方程式表示海水呈弱碱性的原因_________。己知春季海水pH=8.1,预测夏季海水碱性将会_________(填写“增强”或“减弱”),理由是________(写出1条即可)
无机碳 | HCO3- | 90% |
CO32- | 9% | |
CO2 | 1% | |
H2CO3 | ||
其中H2CO3仅为CO2的0.2% | ||
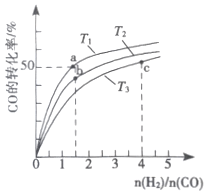
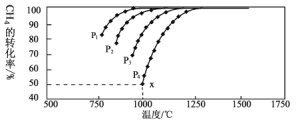
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g) ![]() CH3OH(g) △H<0,在容积为1L 的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的 起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是_________(a、b点横坐标相同,a在曲线T1上,b在曲线T2上)
CH3OH(g) △H<0,在容积为1L 的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的 起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是_________(a、b点横坐标相同,a在曲线T1上,b在曲线T2上)
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点(1.5,50)状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
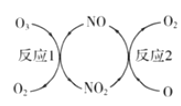
①NO的作用是__________________。
②己知:O3(g)+O(g)=2O2(g) △H =-143kJ·mol-1
反应 1: O3(g)+NO(g) ![]() NO2(g)+O2(g) △H1=-200.2kJ·mol-1
NO2(g)+O2(g) △H1=-200.2kJ·mol-1
反应2:热化学方程式为______________________。
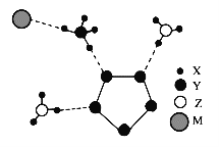
(4)近年来,地下水中的氮污染己成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用 下,密闭容器中的H2可髙效转化酸性溶液中的硝态氮(NO3-)从而降低水体中的氮含量,其工作原理如下图所示
①Ir表面发生反应的方程式为__________________________。
②若导电基体上的Pt颗粒增多,造成的后果是__________________________。

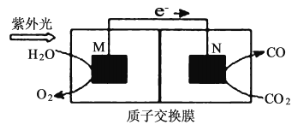
(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示,甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨II附近发生的电极反应式为__________________________。
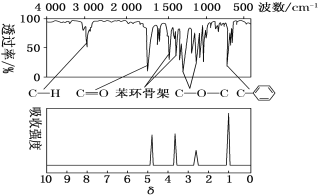
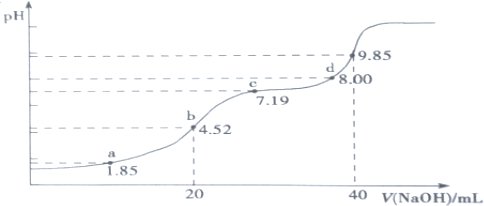
(6)大气污染物SO 2可用NaOH吸收。已知pKa=-lgKa,25℃时,H2SO3 的 pKa1=1.85, pKa2=7.19。该温度下用 0.1mol·L-1NaOH溶液滴定 20mL0.1mol·L-1H2SO3溶液的滴定曲线如下图所示。b点所得溶液中各离子浓度由大到小的顺序是__________________________;c点所得溶液中:c(Na+)__________3c(HSO3-)(填“>”、“<”或“=”)
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼